糖尿病黃斑水腫(DME)是導致糖尿病視網膜病變(DR)患者視功能損害的主要原因。DME一般由視網膜毛細血管滲漏引起且往往與視網膜內大分子物質脂質、蛋白沉積有關,因此其常伴有硬性滲出物(HE)[1]。HE在視網膜中呈黃白色沉積,被認為是由脂質和類蛋白物質組成,是毛細血管壁損傷滲入視網膜的結果,嚴重情況下沉積在視網膜外層或視網膜下方,可以形成纖維化病變,黃斑下HE被認為是頑固性DME的標志[2]。當DME伴HE(DME-HE)時,視網膜激光光凝、抗血管內皮生長因子(VEGF)藥物是其主要治療方式。近年,有學者采用玻璃體切割手術(PPV)聯合視網膜下注射平衡鹽溶液(BSS)治療難治性DME[3]。然而,累及黃斑中心的HE治療后收效甚微或并發癥較多。我們采用PPV聯合內界膜(ILM)剝除、視網膜下注射復方電解質眼內沖洗液(CEIIS)、康柏西普注射治療了一組DME-HE患眼,并與單純玻璃體腔注射康柏西普(IVC)進行對比,以期為今后臨床治療提供參考。現將結果報道如下。
1 對象和方法
前瞻性臨床研究。本研究經濰坊眼科醫院倫理委員會審核通過(批準號:2020-院內倫審-01-02);遵循《赫爾辛基宣言》原則;患者及家屬均獲知情并簽署書面知情同意書。
2020年6月至2022年2月于濰坊眼科醫院檢查確診的DME-HE患者33例36只眼納入本研究。其中,男性15例16只眼,女性18例20只眼;年齡(62.00±6.54)歲。36只眼中,白內障17只眼;人工晶狀體眼19只眼。眼底特征性表現為黃斑區水腫且可見大量黃色滲出物累及黃斑。納入標準:(1)確診為DME-HE[4];(2)治療前接受至少3個月IVC治療,光相干斷層掃描(OCT)檢測黃斑中心凹視網膜厚度(CMT)>300 μm ;(3)OCT檢查證實有視網膜內和(或)視網膜下強反射物質累及黃斑中心凹,且黃斑3 mm×3 mm范圍內HE面積≥1/3個視盤面積。排除標準:(1)既往曾有玻璃體視網膜手術史;(2)既往有老年性黃斑變性、視網膜脫離等其他眼部疾病史;(3)視網膜血管阻塞等其他原因引起的黃斑水腫;(4)患有嚴重呼吸、心血管系統疾病及肝、腎功能較差等無法承受手術者;(5)患有血液系統疾病,凝血功能不佳者;(6)治療后不能按時復診及未按規定重復注藥者。
患眼均行最佳矯正視力(BCVA)、裂隙燈顯微鏡、間接檢眼鏡、掃描激光檢眼鏡(SLO)、OCT、多焦視網膜電圖(mf-ERG)檢查。采用Snellen視力表行BCVA檢查,統計時換算為最小分辨角對數(logMAR)視力。采用德國海德堡公司Spectralis OCT儀測量CMT及黃斑容積(MV),重復測量3次,取平均值。采用SLO(型號:P200DTx)進行SLO成像,按照標準方法進行操作。應用Image J軟件,選取以中心凹為中心3 mm×3 mm的HE區域,并與早期治療DR研究組的網格進行匹配[5];應用軟件中最大熵函數識別HE并自動測量每個裁剪圖像的HE面積[6]。檢查及面積測量均由同一名熟練醫師操作完成。采用德國Roland Consult公司RETIsan檢查系統行mf-ERG檢查。散瞳后患者行屈光矯正,在注視點兩側30°的區域內(總共60°)檢查61個六邊形刺激模式。亮六邊形和暗六邊形的亮度分別保持在100 cd/m2和<1 cd/m2,記錄視網膜電圖[7-8]。以第1個正波為P1波,測量1環P1波振幅密度。
隨機將患者分為A組、B組,分別為17例18只眼、16例18只眼。A組行PPV聯合ILM剝除以及視網膜下注射CEIIS、康柏西普治療;B組行IVC治療。兩組患者年齡、logMAR BCVA、HE面積、CMT、MV、1環P1波振幅密度比較,差異均無統計學意義(P>0.05)(表1)。
 ±s)
±s)
A組患眼行經睫狀體平坦部標準三通道23G微創PPV。手術由同一名經驗豐富的醫師使用同一手術系統操作完成。切除玻璃體,剝除ILM,48G視網膜下穿刺針針頭于ILM剝離區避開黃斑中心凹,視網膜下注射0.05~0.10 ml CEIIS,誘導黃斑裂孔形成,繼續注射CEIIS,可見黃斑中心凹HE通過黃斑裂孔溢出;行氣-液交換,鞏膜穿刺口注入10 mg/ml康柏西普0.05 ml。手術后俯臥位3 d。B組患眼玻璃體腔注射10 mg/ml康柏西普0.05 ml。隨訪期間,兩組患眼均按需給予IVC治療;手術與IVC、2次IVC之間,最少間隔1個月。若CMT>300 μm持續存在或黃斑水腫復發,則恢復IVC治療[4]。
隨訪時間12個月。治療后1周及1、3、6、12個月采用治療前相同設備和方法行相關檢查。對比觀察兩組患者組內和組間治療后12個月logMAR BCVA、HE面積、CMT、MV、1環P1波振幅密度變化,治療后注藥次數以及并發癥發生情況。
采用SPSS26.0軟件行統計分析。數據符合正態分布,計量資料以均數±標準差( ±s)表示。組內治療前后logMAR BCVA、HE面積、CMT、MV、1環P1波振幅密度比較,方差齊采用單因素重復測量方差分析,方差不齊采用廣義估計方程。兩組間比較采用獨立樣本t檢驗。P<0.05為差異有統計學意義。
±s)表示。組內治療前后logMAR BCVA、HE面積、CMT、MV、1環P1波振幅密度比較,方差齊采用單因素重復測量方差分析,方差不齊采用廣義估計方程。兩組間比較采用獨立樣本t檢驗。P<0.05為差異有統計學意義。
2 結果
隨訪期間,A 組、B組患眼注藥次數分別為(3.06±1.89)(約等于注射1次/16周)、(5.56±2.04)次(約等于注射1次/8周);兩組患者重復注藥次數比較,差異有統計學意義(t=-3.815,P=0.001)。
與治療前logMAR BCVA比較,A組患眼治療后1周及1個月時,差異無統計學意義(P>0.05);治療后3、6、12個月時,差異均有統計學意義(P<0.001)。B組患眼治療后不同時間logMAR BCVA與治療前比較,差異均無統計學意義(P<0.001)。A組、B組患眼間logMAR BCVA比較,治療后1周及6、12個月時,差異有統計學意義(P<0.05);1、3個月時,差異無統計學意義(P>0.05)(表2)。
 ±s)
±s)
與治療前HE面積比較,A組患眼治療后1周及1、3、6、12個月時,差異均有統計學意義(P<0.001)(圖1);B組患眼治療后1周及1、3、6、12個月時,差異均無統計學意義(P>0.05)。A組、B組患眼間治療后不同時間HE面積比較,治療后1周時,差異無統計學意義(P>0.05);治療后1、3、6、12個月時,差異均有統計學意義(P<0.05)(表2)。
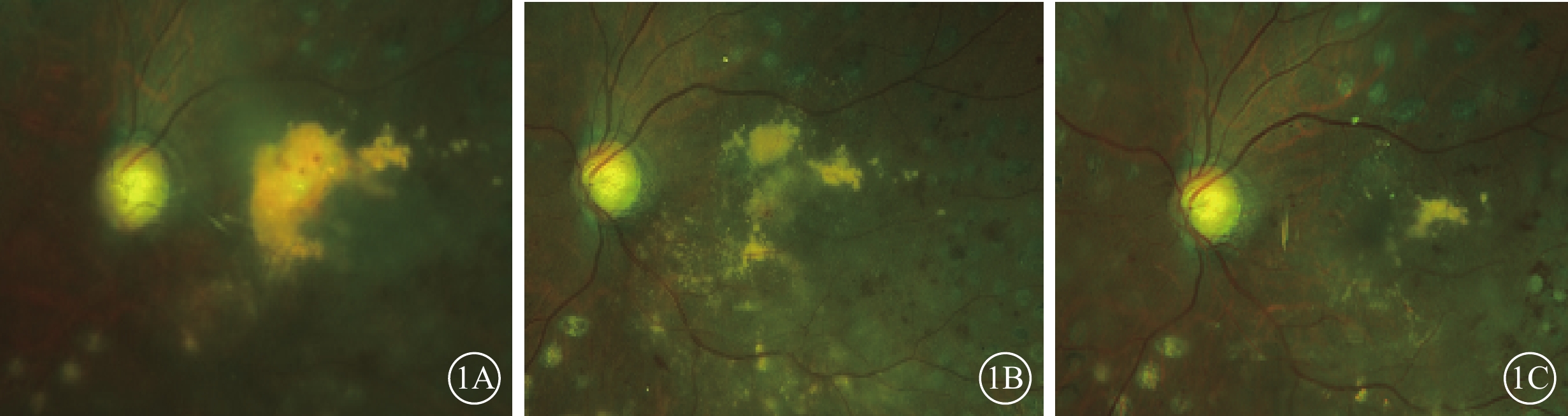
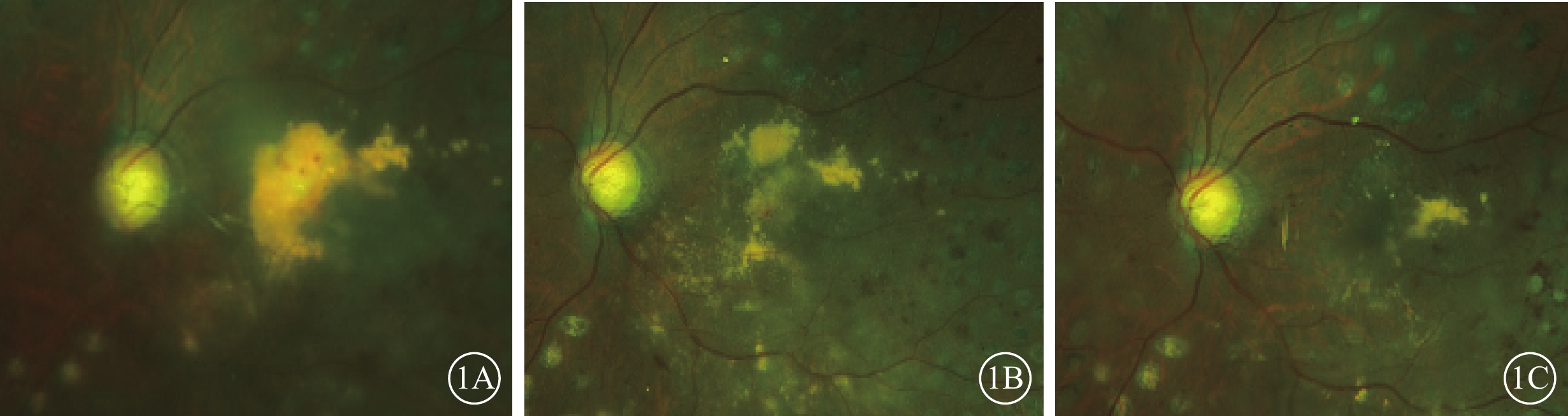 圖1
A組患眼彩色眼底像 患眼接受玻璃體切割、內界膜剝除、視網膜下注射復方電解質眼內沖洗液聯合康柏西普治療。1A~1C分別示治療前及治療后3、12個月,黃斑區硬性滲出物面積逐漸減少
圖1
A組患眼彩色眼底像 患眼接受玻璃體切割、內界膜剝除、視網膜下注射復方電解質眼內沖洗液聯合康柏西普治療。1A~1C分別示治療前及治療后3、12個月,黃斑區硬性滲出物面積逐漸減少
與治療前CMT、MV比較,A組、B組患眼治療后1周及1、3、6、12個月時,差異均有統計學意義(P<0.001)。A組、B組患眼間CMT、MV比較,治療后12個月時,差異有統計學意義(P<0.05);治療后1周及1、3、6個月時,差異均無統計學意義(P>0.05)(表3;圖2,3)。
 ±s)
±s)
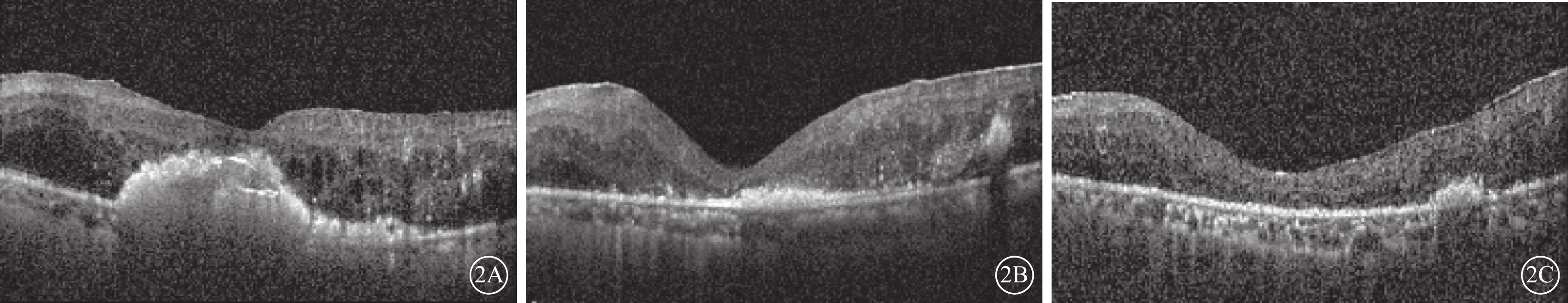
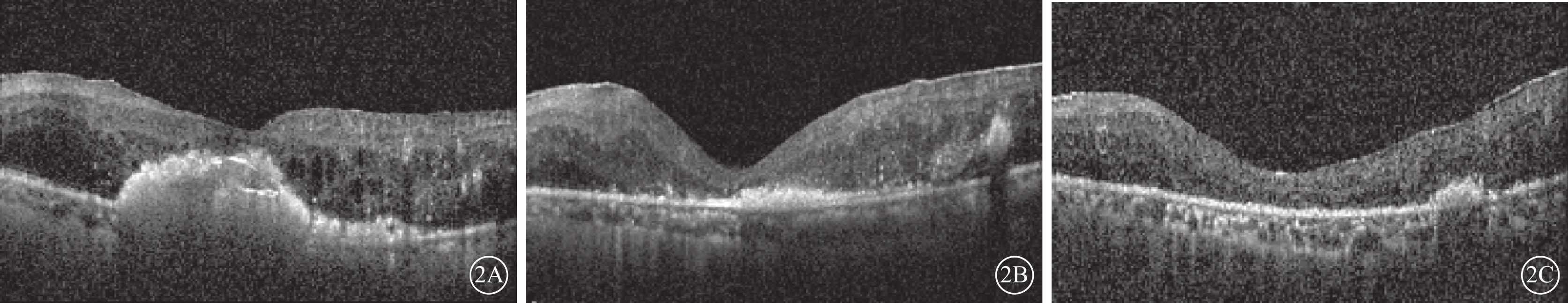 圖2
A組患眼光相干斷層掃描像 患眼接受玻璃體切割、內界膜剝除、視網膜下注射復方電解質眼內沖洗液聯合康柏西普治療。2A~2C分別示治療前及治療后3、12個月,位于視網膜下黃斑區硬性滲出物逐漸減少,視網膜中心凹厚度逐漸降低
圖2
A組患眼光相干斷層掃描像 患眼接受玻璃體切割、內界膜剝除、視網膜下注射復方電解質眼內沖洗液聯合康柏西普治療。2A~2C分別示治療前及治療后3、12個月,位于視網膜下黃斑區硬性滲出物逐漸減少,視網膜中心凹厚度逐漸降低
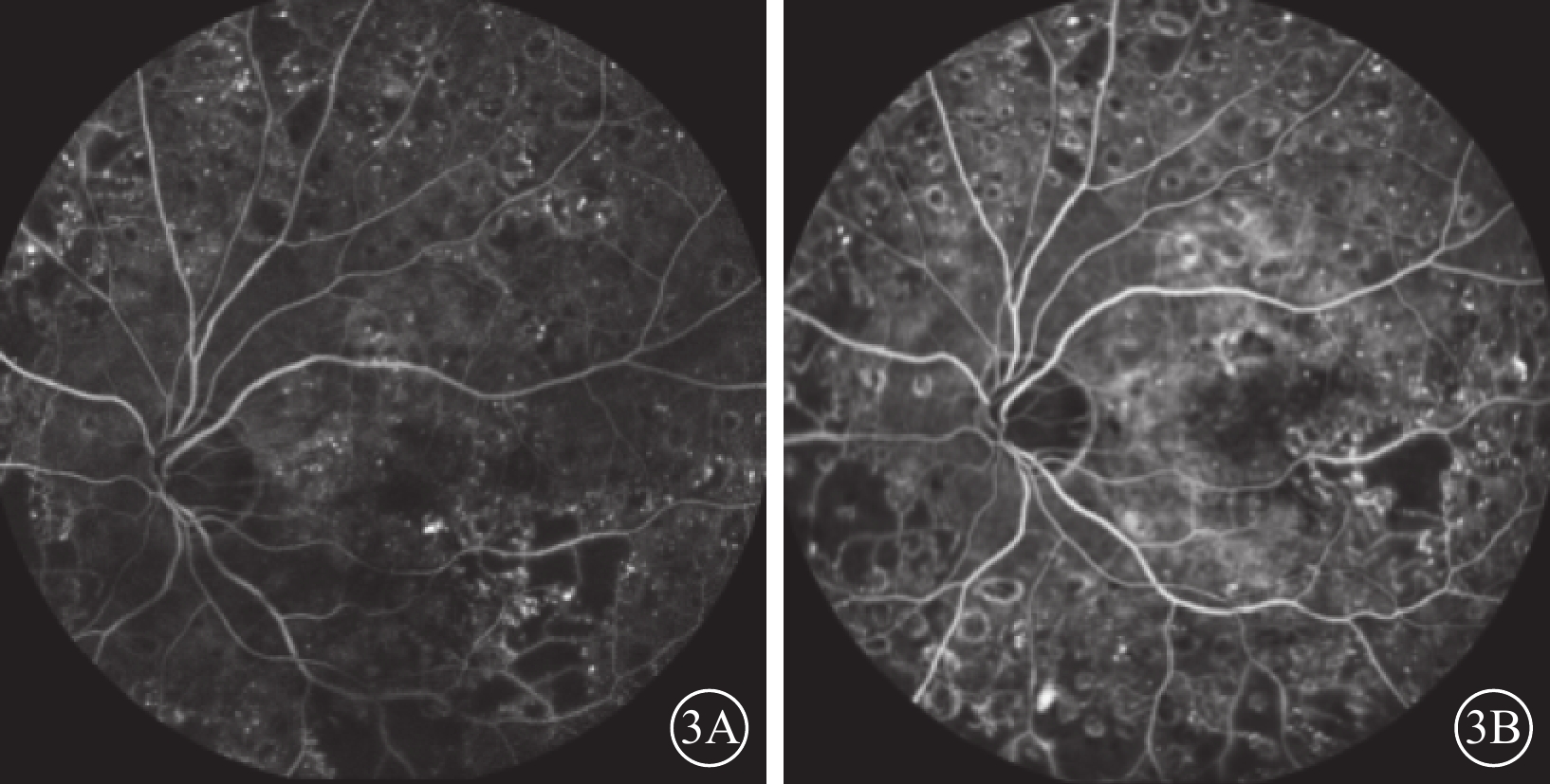
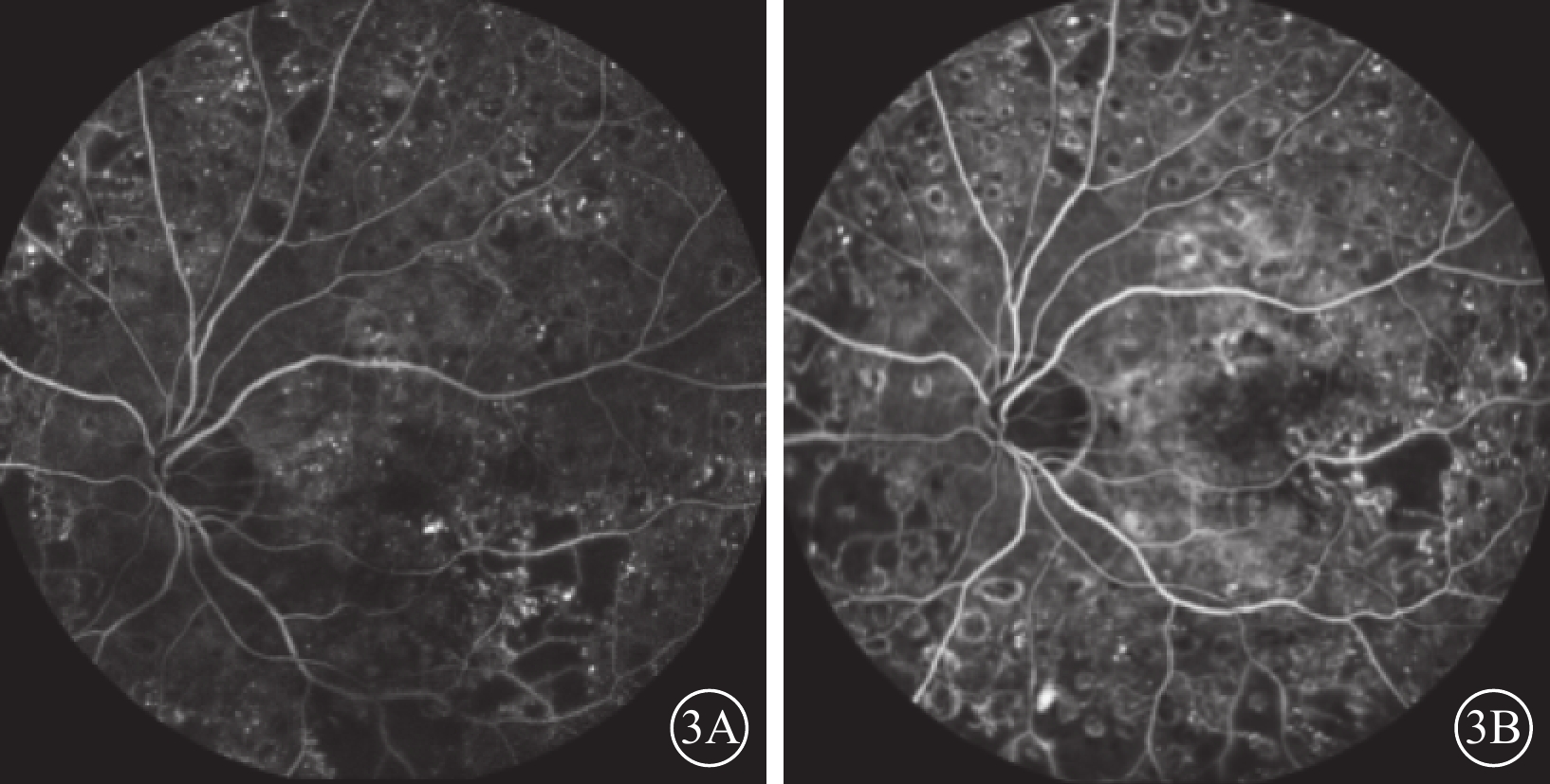 圖3
A組患眼熒光素眼底血管造影像 患眼接受玻璃體切割、內界膜剝除、視網膜下注射復方電解質眼內沖洗液聯合康柏西普治療。3A示治療前,視網膜可見片狀無灌注區,大量點狀強熒光素滲漏;黃斑區可見熒光素滲漏及黃斑中心凹偏上方因硬性滲出物遮擋呈弱熒光。3B示治療后12個月,視網膜可見片狀無灌注區,大量點狀強熒光素滲漏;黃斑區硬性滲出物遮蔽弱熒光區較治療前熒光增強
圖3
A組患眼熒光素眼底血管造影像 患眼接受玻璃體切割、內界膜剝除、視網膜下注射復方電解質眼內沖洗液聯合康柏西普治療。3A示治療前,視網膜可見片狀無灌注區,大量點狀強熒光素滲漏;黃斑區可見熒光素滲漏及黃斑中心凹偏上方因硬性滲出物遮擋呈弱熒光。3B示治療后12個月,視網膜可見片狀無灌注區,大量點狀強熒光素滲漏;黃斑區硬性滲出物遮蔽弱熒光區較治療前熒光增強
與治療前mf-ERG 1環P1波振幅密度比較,A組患眼治療后1周及1、3、6個月時,差異均無統計學意義(P>0.05);治療后12個月時,差異有統計學意義(F=8.933,P=0.023)。B組患眼治療后mf-ERG 1環P1波振幅密度與治療前比較,治療后1周及1、3、6、12個月時,差異均無統計學意義(F=0.178,P =0.946)。A組、B組患眼間治療后不同時間1環P1波振幅密度比較,治療后1周及1、3、6個月時,差異均無統計學意義(P>0.05);治療后12個月時,差異有統計學意義(P<0.05)(表4)。
 ±s)
±s)
隨訪期間,A 組、B組患眼發生黃斑裂孔、玻璃體積血各1只眼(5.56%);其余患眼均未發生嚴重眼底并發癥。
3 討論
DME可發生在DR任意時期,是導致患者視力損害的主要原因[9],尤其是合并的HE位于黃斑區時,患者視力將嚴重受到影響。DME主要原因是視網膜血管的高通透性造成液體集聚在視網膜下和伴有脂質、蛋白類物質的沉積,HE的產生是因為脂蛋白從通透性變高的毛細血管泄漏至視網膜細胞外間隙中,并多數沉積在后極部[9-10]。目前,抗VEGF藥物是治療DME的臨床一線手段,但視網膜激光光凝仍占據重要地位,激光光凝在封堵無灌注區及減少新生血管生成方面是明確、有效的手段,常與抗VEGF藥物共同使用,但對HE的減少無顯著作用[11]。當DME且黃斑區合并有HE時,目前治療方法不一,且并無統一有效的方法。
本研究結果顯示,PPV聯合ILM剝除、視網膜下注射CEIIS聯合康柏西普治療能夠有效清除HE和減輕黃斑水腫,與IVC治療比較,BCVA顯著提高。治療后12個月,A組患眼視力改善,且隨訪期間多數患者未發生嚴重并發癥;但B組患眼視力未見明顯提高,其原因可能與觀察時間短、入組樣本量較小有關。當使用抗VEGF藥物時,易擴散的液體首先被吸收,而大分子物質HE需要更久時間吸收,HE可能需要吞噬性炎性細胞的清除[12]。治療后12個月時,A組患眼HE面積顯著減少,B組HE面積未見明顯變化。A組多種因素作用于HE,PPV降低了VEGF和其他炎癥因子的濃度,極大改善了視網膜微環境,且注射CEIIS溶液,水流的沖刷作用也使HE快速減少,ILM剝除也有利于HE吸收[13-14];B組作用因素單一,HE消退較緩慢。Domalpally等[15]研究發現,抗VEGF藥物治療后24個月時,患眼HE面積減少,提示抗VEGF藥物治療HE有效,但需要觀察周期更長。本研究隨訪時間較短,未觀察到抗VEGF藥物對HE的明顯消除作用,后續將持續隨訪,觀察更長時間周期內B組對HE的療效。
本研究結果顯示,A組、B組患眼治療后CMT、MV降低,治療后12個月時,上述指標A組均優于B組。A組作用機制可能如下:(1)CEIIS溶液進入視網膜下,可以使膠體滲透壓、視網膜下液(SRF)濃度下降,并且促使小分子液體通過視網膜色素上皮(RPE)泵流入脈絡膜[16];(2)SRF吸收后,視網膜與RPE重新接觸,使得從脈絡膜至視網膜的營養和氧氣供應得以恢復;(3)CEIIS溶液可以沖刷掉RPE上的炎性細胞因子,當炎癥因子消減后,RPE功能也較前恢復,進一步減輕黃斑水腫[17];(4)PPV降低了玻璃體腔內的VEGF及炎癥因子的濃度,并解除玻璃體對視網膜的牽拉,改善眼內微環境[18];(5)糖尿病患者ILM增厚,可能導致玻璃體和視網膜之間的水分運動出現結構和功能障礙,ILM的剝除可以消除殘留的玻璃體后皮質和ILM對視網膜施加的切線牽引作用,防止視網膜前膜的形成,且改善氧氣供應,也有助于DME的消退[4, 19-20]。因此,A組、B組患眼CMT、MV均下降,但A組在治療后12個月時下降更為明顯,兩組差異有統計學意義。這說明長期觀察下,A組方案效果更好。治療后12個月時,A組1環P1波振幅密度較治療前提高,B組則無顯著差異。mf-ERG以波的極性命名,第一個正向波稱為P1波,反映黃斑及后極部每個對應區域視網膜細胞功能,1環代表黃斑中心凹視功能變化,振幅越高提示功能越好[21]。A組在治療后1周及1、3、6個月時1環P1波振幅密度較治療前無顯著差異,說明視功能的恢復可能需要一定時間,也可能因為HE的長期沉積對黃斑中心凹處毒害作用較強,因此恢復緩慢[22]。B組因HE消失緩慢,且HE累及中心凹,對黃斑的損害持續存在,1環P1波振幅密度未提高。治療后12個月時,A組需重復注藥的次數顯著低于B組,說明A組治療方案減輕水腫和HE明顯,且后續重復注藥花費少于B組。
有學者采用PPV聯合視網膜下注射,使頑固性DME得以改善,剝除ILM后,38G針刺穿視網膜并注入BSS [21]。Iwane等[23]采用PPV后以黃斑中心凹為原點剝離下半部ILM,將上半部存留的掀蓋設計,通過使用ILM鑷創建黃斑裂孔后,用BSS將HE從黃斑裂孔中沖洗出來,治療后患眼視力有所改善,但ILM鑷人為造成的黃斑裂孔創口較大,且裂孔大小不易掌握。本研究結合了大量研究設計治療方案,通過水流形成的黃斑裂孔沖刷HE,在水流作用下,HE自黃斑裂孔溢出,由于孔洞的形成是液壓所致,因此可以采用最小的侵入性完成,此外使用水流比ILM鑷具有更小的損傷性。本研究使用48G視網膜下穿刺針,穿刺口更小,對視網膜造成的損傷更小,更容易控制水流的量[14];同時將BSS換成CEIIS溶液。CEIIS為國產眼內灌注液,pH和滲透壓接近于房水,能更好地保護角膜中央區內皮細胞,甚至可以降低PPV后易誘發的白內障發生率;對提高角膜內皮細胞、RPE細胞和視網膜神經節細胞的活性和減少細胞凋亡,具有明顯作用;細胞連接更為緊密,氧化損傷相對減輕[24]。本研究中A組聯合抗VEGF藥物,進一步降低眼內炎癥的發生,有利于患者預后。
本研究具有一定的局限性:(1)A組采用聯合治療的手術方式,PPV、剝除ILM和視網膜下注射三者創傷較大,且聯合康柏西普治療,費用遠高于常規治療,雖減少注藥次數,但仍加重糖尿病患者的經濟負擔。(2)B組患者經多次重復注藥治療,但在觀察期內視力未見顯著提高,HE面積也未見明顯消退,易讓患者對治療產生抵觸情緒。(3)觀察周期較短,DME、HE作為長期慢性疾病的并發癥,應延長觀察隨訪時間,擴大觀察人數,而本次研究樣本量少。盡管如此,本研究結果仍可為臨床治療DME-HE提供一定參考。
糖尿病黃斑水腫(DME)是導致糖尿病視網膜病變(DR)患者視功能損害的主要原因。DME一般由視網膜毛細血管滲漏引起且往往與視網膜內大分子物質脂質、蛋白沉積有關,因此其常伴有硬性滲出物(HE)[1]。HE在視網膜中呈黃白色沉積,被認為是由脂質和類蛋白物質組成,是毛細血管壁損傷滲入視網膜的結果,嚴重情況下沉積在視網膜外層或視網膜下方,可以形成纖維化病變,黃斑下HE被認為是頑固性DME的標志[2]。當DME伴HE(DME-HE)時,視網膜激光光凝、抗血管內皮生長因子(VEGF)藥物是其主要治療方式。近年,有學者采用玻璃體切割手術(PPV)聯合視網膜下注射平衡鹽溶液(BSS)治療難治性DME[3]。然而,累及黃斑中心的HE治療后收效甚微或并發癥較多。我們采用PPV聯合內界膜(ILM)剝除、視網膜下注射復方電解質眼內沖洗液(CEIIS)、康柏西普注射治療了一組DME-HE患眼,并與單純玻璃體腔注射康柏西普(IVC)進行對比,以期為今后臨床治療提供參考。現將結果報道如下。
1 對象和方法
前瞻性臨床研究。本研究經濰坊眼科醫院倫理委員會審核通過(批準號:2020-院內倫審-01-02);遵循《赫爾辛基宣言》原則;患者及家屬均獲知情并簽署書面知情同意書。
2020年6月至2022年2月于濰坊眼科醫院檢查確診的DME-HE患者33例36只眼納入本研究。其中,男性15例16只眼,女性18例20只眼;年齡(62.00±6.54)歲。36只眼中,白內障17只眼;人工晶狀體眼19只眼。眼底特征性表現為黃斑區水腫且可見大量黃色滲出物累及黃斑。納入標準:(1)確診為DME-HE[4];(2)治療前接受至少3個月IVC治療,光相干斷層掃描(OCT)檢測黃斑中心凹視網膜厚度(CMT)>300 μm ;(3)OCT檢查證實有視網膜內和(或)視網膜下強反射物質累及黃斑中心凹,且黃斑3 mm×3 mm范圍內HE面積≥1/3個視盤面積。排除標準:(1)既往曾有玻璃體視網膜手術史;(2)既往有老年性黃斑變性、視網膜脫離等其他眼部疾病史;(3)視網膜血管阻塞等其他原因引起的黃斑水腫;(4)患有嚴重呼吸、心血管系統疾病及肝、腎功能較差等無法承受手術者;(5)患有血液系統疾病,凝血功能不佳者;(6)治療后不能按時復診及未按規定重復注藥者。
患眼均行最佳矯正視力(BCVA)、裂隙燈顯微鏡、間接檢眼鏡、掃描激光檢眼鏡(SLO)、OCT、多焦視網膜電圖(mf-ERG)檢查。采用Snellen視力表行BCVA檢查,統計時換算為最小分辨角對數(logMAR)視力。采用德國海德堡公司Spectralis OCT儀測量CMT及黃斑容積(MV),重復測量3次,取平均值。采用SLO(型號:P200DTx)進行SLO成像,按照標準方法進行操作。應用Image J軟件,選取以中心凹為中心3 mm×3 mm的HE區域,并與早期治療DR研究組的網格進行匹配[5];應用軟件中最大熵函數識別HE并自動測量每個裁剪圖像的HE面積[6]。檢查及面積測量均由同一名熟練醫師操作完成。采用德國Roland Consult公司RETIsan檢查系統行mf-ERG檢查。散瞳后患者行屈光矯正,在注視點兩側30°的區域內(總共60°)檢查61個六邊形刺激模式。亮六邊形和暗六邊形的亮度分別保持在100 cd/m2和<1 cd/m2,記錄視網膜電圖[7-8]。以第1個正波為P1波,測量1環P1波振幅密度。
隨機將患者分為A組、B組,分別為17例18只眼、16例18只眼。A組行PPV聯合ILM剝除以及視網膜下注射CEIIS、康柏西普治療;B組行IVC治療。兩組患者年齡、logMAR BCVA、HE面積、CMT、MV、1環P1波振幅密度比較,差異均無統計學意義(P>0.05)(表1)。
 ±s)
±s)
A組患眼行經睫狀體平坦部標準三通道23G微創PPV。手術由同一名經驗豐富的醫師使用同一手術系統操作完成。切除玻璃體,剝除ILM,48G視網膜下穿刺針針頭于ILM剝離區避開黃斑中心凹,視網膜下注射0.05~0.10 ml CEIIS,誘導黃斑裂孔形成,繼續注射CEIIS,可見黃斑中心凹HE通過黃斑裂孔溢出;行氣-液交換,鞏膜穿刺口注入10 mg/ml康柏西普0.05 ml。手術后俯臥位3 d。B組患眼玻璃體腔注射10 mg/ml康柏西普0.05 ml。隨訪期間,兩組患眼均按需給予IVC治療;手術與IVC、2次IVC之間,最少間隔1個月。若CMT>300 μm持續存在或黃斑水腫復發,則恢復IVC治療[4]。
隨訪時間12個月。治療后1周及1、3、6、12個月采用治療前相同設備和方法行相關檢查。對比觀察兩組患者組內和組間治療后12個月logMAR BCVA、HE面積、CMT、MV、1環P1波振幅密度變化,治療后注藥次數以及并發癥發生情況。
采用SPSS26.0軟件行統計分析。數據符合正態分布,計量資料以均數±標準差( ±s)表示。組內治療前后logMAR BCVA、HE面積、CMT、MV、1環P1波振幅密度比較,方差齊采用單因素重復測量方差分析,方差不齊采用廣義估計方程。兩組間比較采用獨立樣本t檢驗。P<0.05為差異有統計學意義。
±s)表示。組內治療前后logMAR BCVA、HE面積、CMT、MV、1環P1波振幅密度比較,方差齊采用單因素重復測量方差分析,方差不齊采用廣義估計方程。兩組間比較采用獨立樣本t檢驗。P<0.05為差異有統計學意義。
2 結果
隨訪期間,A 組、B組患眼注藥次數分別為(3.06±1.89)(約等于注射1次/16周)、(5.56±2.04)次(約等于注射1次/8周);兩組患者重復注藥次數比較,差異有統計學意義(t=-3.815,P=0.001)。
與治療前logMAR BCVA比較,A組患眼治療后1周及1個月時,差異無統計學意義(P>0.05);治療后3、6、12個月時,差異均有統計學意義(P<0.001)。B組患眼治療后不同時間logMAR BCVA與治療前比較,差異均無統計學意義(P<0.001)。A組、B組患眼間logMAR BCVA比較,治療后1周及6、12個月時,差異有統計學意義(P<0.05);1、3個月時,差異無統計學意義(P>0.05)(表2)。
 ±s)
±s)
與治療前HE面積比較,A組患眼治療后1周及1、3、6、12個月時,差異均有統計學意義(P<0.001)(圖1);B組患眼治療后1周及1、3、6、12個月時,差異均無統計學意義(P>0.05)。A組、B組患眼間治療后不同時間HE面積比較,治療后1周時,差異無統計學意義(P>0.05);治療后1、3、6、12個月時,差異均有統計學意義(P<0.05)(表2)。
 圖1
A組患眼彩色眼底像 患眼接受玻璃體切割、內界膜剝除、視網膜下注射復方電解質眼內沖洗液聯合康柏西普治療。1A~1C分別示治療前及治療后3、12個月,黃斑區硬性滲出物面積逐漸減少
圖1
A組患眼彩色眼底像 患眼接受玻璃體切割、內界膜剝除、視網膜下注射復方電解質眼內沖洗液聯合康柏西普治療。1A~1C分別示治療前及治療后3、12個月,黃斑區硬性滲出物面積逐漸減少
與治療前CMT、MV比較,A組、B組患眼治療后1周及1、3、6、12個月時,差異均有統計學意義(P<0.001)。A組、B組患眼間CMT、MV比較,治療后12個月時,差異有統計學意義(P<0.05);治療后1周及1、3、6個月時,差異均無統計學意義(P>0.05)(表3;圖2,3)。
 ±s)
±s)
 圖2
A組患眼光相干斷層掃描像 患眼接受玻璃體切割、內界膜剝除、視網膜下注射復方電解質眼內沖洗液聯合康柏西普治療。2A~2C分別示治療前及治療后3、12個月,位于視網膜下黃斑區硬性滲出物逐漸減少,視網膜中心凹厚度逐漸降低
圖2
A組患眼光相干斷層掃描像 患眼接受玻璃體切割、內界膜剝除、視網膜下注射復方電解質眼內沖洗液聯合康柏西普治療。2A~2C分別示治療前及治療后3、12個月,位于視網膜下黃斑區硬性滲出物逐漸減少,視網膜中心凹厚度逐漸降低
 圖3
A組患眼熒光素眼底血管造影像 患眼接受玻璃體切割、內界膜剝除、視網膜下注射復方電解質眼內沖洗液聯合康柏西普治療。3A示治療前,視網膜可見片狀無灌注區,大量點狀強熒光素滲漏;黃斑區可見熒光素滲漏及黃斑中心凹偏上方因硬性滲出物遮擋呈弱熒光。3B示治療后12個月,視網膜可見片狀無灌注區,大量點狀強熒光素滲漏;黃斑區硬性滲出物遮蔽弱熒光區較治療前熒光增強
圖3
A組患眼熒光素眼底血管造影像 患眼接受玻璃體切割、內界膜剝除、視網膜下注射復方電解質眼內沖洗液聯合康柏西普治療。3A示治療前,視網膜可見片狀無灌注區,大量點狀強熒光素滲漏;黃斑區可見熒光素滲漏及黃斑中心凹偏上方因硬性滲出物遮擋呈弱熒光。3B示治療后12個月,視網膜可見片狀無灌注區,大量點狀強熒光素滲漏;黃斑區硬性滲出物遮蔽弱熒光區較治療前熒光增強
與治療前mf-ERG 1環P1波振幅密度比較,A組患眼治療后1周及1、3、6個月時,差異均無統計學意義(P>0.05);治療后12個月時,差異有統計學意義(F=8.933,P=0.023)。B組患眼治療后mf-ERG 1環P1波振幅密度與治療前比較,治療后1周及1、3、6、12個月時,差異均無統計學意義(F=0.178,P =0.946)。A組、B組患眼間治療后不同時間1環P1波振幅密度比較,治療后1周及1、3、6個月時,差異均無統計學意義(P>0.05);治療后12個月時,差異有統計學意義(P<0.05)(表4)。
 ±s)
±s)
隨訪期間,A 組、B組患眼發生黃斑裂孔、玻璃體積血各1只眼(5.56%);其余患眼均未發生嚴重眼底并發癥。
3 討論
DME可發生在DR任意時期,是導致患者視力損害的主要原因[9],尤其是合并的HE位于黃斑區時,患者視力將嚴重受到影響。DME主要原因是視網膜血管的高通透性造成液體集聚在視網膜下和伴有脂質、蛋白類物質的沉積,HE的產生是因為脂蛋白從通透性變高的毛細血管泄漏至視網膜細胞外間隙中,并多數沉積在后極部[9-10]。目前,抗VEGF藥物是治療DME的臨床一線手段,但視網膜激光光凝仍占據重要地位,激光光凝在封堵無灌注區及減少新生血管生成方面是明確、有效的手段,常與抗VEGF藥物共同使用,但對HE的減少無顯著作用[11]。當DME且黃斑區合并有HE時,目前治療方法不一,且并無統一有效的方法。
本研究結果顯示,PPV聯合ILM剝除、視網膜下注射CEIIS聯合康柏西普治療能夠有效清除HE和減輕黃斑水腫,與IVC治療比較,BCVA顯著提高。治療后12個月,A組患眼視力改善,且隨訪期間多數患者未發生嚴重并發癥;但B組患眼視力未見明顯提高,其原因可能與觀察時間短、入組樣本量較小有關。當使用抗VEGF藥物時,易擴散的液體首先被吸收,而大分子物質HE需要更久時間吸收,HE可能需要吞噬性炎性細胞的清除[12]。治療后12個月時,A組患眼HE面積顯著減少,B組HE面積未見明顯變化。A組多種因素作用于HE,PPV降低了VEGF和其他炎癥因子的濃度,極大改善了視網膜微環境,且注射CEIIS溶液,水流的沖刷作用也使HE快速減少,ILM剝除也有利于HE吸收[13-14];B組作用因素單一,HE消退較緩慢。Domalpally等[15]研究發現,抗VEGF藥物治療后24個月時,患眼HE面積減少,提示抗VEGF藥物治療HE有效,但需要觀察周期更長。本研究隨訪時間較短,未觀察到抗VEGF藥物對HE的明顯消除作用,后續將持續隨訪,觀察更長時間周期內B組對HE的療效。
本研究結果顯示,A組、B組患眼治療后CMT、MV降低,治療后12個月時,上述指標A組均優于B組。A組作用機制可能如下:(1)CEIIS溶液進入視網膜下,可以使膠體滲透壓、視網膜下液(SRF)濃度下降,并且促使小分子液體通過視網膜色素上皮(RPE)泵流入脈絡膜[16];(2)SRF吸收后,視網膜與RPE重新接觸,使得從脈絡膜至視網膜的營養和氧氣供應得以恢復;(3)CEIIS溶液可以沖刷掉RPE上的炎性細胞因子,當炎癥因子消減后,RPE功能也較前恢復,進一步減輕黃斑水腫[17];(4)PPV降低了玻璃體腔內的VEGF及炎癥因子的濃度,并解除玻璃體對視網膜的牽拉,改善眼內微環境[18];(5)糖尿病患者ILM增厚,可能導致玻璃體和視網膜之間的水分運動出現結構和功能障礙,ILM的剝除可以消除殘留的玻璃體后皮質和ILM對視網膜施加的切線牽引作用,防止視網膜前膜的形成,且改善氧氣供應,也有助于DME的消退[4, 19-20]。因此,A組、B組患眼CMT、MV均下降,但A組在治療后12個月時下降更為明顯,兩組差異有統計學意義。這說明長期觀察下,A組方案效果更好。治療后12個月時,A組1環P1波振幅密度較治療前提高,B組則無顯著差異。mf-ERG以波的極性命名,第一個正向波稱為P1波,反映黃斑及后極部每個對應區域視網膜細胞功能,1環代表黃斑中心凹視功能變化,振幅越高提示功能越好[21]。A組在治療后1周及1、3、6個月時1環P1波振幅密度較治療前無顯著差異,說明視功能的恢復可能需要一定時間,也可能因為HE的長期沉積對黃斑中心凹處毒害作用較強,因此恢復緩慢[22]。B組因HE消失緩慢,且HE累及中心凹,對黃斑的損害持續存在,1環P1波振幅密度未提高。治療后12個月時,A組需重復注藥的次數顯著低于B組,說明A組治療方案減輕水腫和HE明顯,且后續重復注藥花費少于B組。
有學者采用PPV聯合視網膜下注射,使頑固性DME得以改善,剝除ILM后,38G針刺穿視網膜并注入BSS [21]。Iwane等[23]采用PPV后以黃斑中心凹為原點剝離下半部ILM,將上半部存留的掀蓋設計,通過使用ILM鑷創建黃斑裂孔后,用BSS將HE從黃斑裂孔中沖洗出來,治療后患眼視力有所改善,但ILM鑷人為造成的黃斑裂孔創口較大,且裂孔大小不易掌握。本研究結合了大量研究設計治療方案,通過水流形成的黃斑裂孔沖刷HE,在水流作用下,HE自黃斑裂孔溢出,由于孔洞的形成是液壓所致,因此可以采用最小的侵入性完成,此外使用水流比ILM鑷具有更小的損傷性。本研究使用48G視網膜下穿刺針,穿刺口更小,對視網膜造成的損傷更小,更容易控制水流的量[14];同時將BSS換成CEIIS溶液。CEIIS為國產眼內灌注液,pH和滲透壓接近于房水,能更好地保護角膜中央區內皮細胞,甚至可以降低PPV后易誘發的白內障發生率;對提高角膜內皮細胞、RPE細胞和視網膜神經節細胞的活性和減少細胞凋亡,具有明顯作用;細胞連接更為緊密,氧化損傷相對減輕[24]。本研究中A組聯合抗VEGF藥物,進一步降低眼內炎癥的發生,有利于患者預后。
本研究具有一定的局限性:(1)A組采用聯合治療的手術方式,PPV、剝除ILM和視網膜下注射三者創傷較大,且聯合康柏西普治療,費用遠高于常規治療,雖減少注藥次數,但仍加重糖尿病患者的經濟負擔。(2)B組患者經多次重復注藥治療,但在觀察期內視力未見顯著提高,HE面積也未見明顯消退,易讓患者對治療產生抵觸情緒。(3)觀察周期較短,DME、HE作為長期慢性疾病的并發癥,應延長觀察隨訪時間,擴大觀察人數,而本次研究樣本量少。盡管如此,本研究結果仍可為臨床治療DME-HE提供一定參考。