引用本文: 傅麒寧, 吳洲鵬, 孫文彥, 朱越鋒, 何佩儀, 齊立行, 成芳, 趙紀春, 趙渝, 國際血管聯盟中國分會, 中國老年醫學學會周圍血管疾病管理分會. 《輸液導管相關靜脈血栓形成中國專家共識》臨床實踐推薦. 中國普外基礎與臨床雜志, 2020, 27(4): 412-418. doi: 10.7507/1007-9424.202001030 復制
隨著靜脈輸液導管,如經外周置入中心靜脈導管(peripherally inserted central catheter,PICC)、輸液港、中長導管等在臨床使用的日益普遍,導管相關靜脈血栓形成(catheter related thrombosis,CRT)作為其常見并發癥日益受到臨床重視。但由于目前國內相當部分醫療機構沒有血管外科作為支撐,在發生 CRT 之后缺乏處置經驗,導致了很多臨床問題。而目前國際指南對該部分內容描述簡單,內容單薄,很多情況下無法指導臨床依此開展工作。在此種背景下,國際血管聯盟中國分會和中國老年醫學學會周圍血管疾病管理分會聯合發起編制了第一版《輸液導管相關靜脈血栓形成中國專家共識》。基于該版專家共識,我們對臨床工作進行以下實踐推薦。由于導管相關領域研究相對較少,高質量研究稀缺,在臨床實踐推薦中我們不對推薦意見進行等級劃分。
1 預防方面的建議
1.1 人員培訓
規范的置管操作,規范使用和維護導管,以及專業的護理團隊是降低包括血栓在內的導管相關并發癥的重要先決條件[1]。我們建議開展靜脈輸液治療相關培訓,并對護士的靜脈輸液治療理論知識和技術能力進行評價與認證,同時應組建專業的靜脈通路管理(或靜脈治療或輸液)團隊[2-3]。
1.2 風險評估
CRT 的發生往往是多個危險因素疊加的結果。合理應用量表進行判斷可能更有價值,但目前臨床上并無公認的量表可以使用。需要考慮的常見危險因素包括但不限于以下情況[3-4]。
1.2.1
有深靜脈血栓(deep venous thrombosis,DVT)病史或家族史(對于有病史的患者應了解其使用抗凝藥物的情況并做充分評估,還需注意藥物引起的出血風險)。
1.2.2
存在導致高凝狀態的慢性疾病,比如惡性腫瘤、腎病綜合征、慢性阻塞性肺病等。
1.2.3
骨科大手術等靜脈血栓栓塞癥(venous thromboembolism,VTE)高危風險手術患者、復合創傷患者及危重患者。
1.2.4
已知存在凝血異常基因,如凝血因子Ⅴ異常或凝血酶原基因突變。
1.2.5
懷孕或者口服避孕藥者。
1.2.6
有多次置入中心靜脈通路裝置(central venous access device,CVAD)的病史,尤其是困難或者損傷性置入史者。
1.2.7
同時存在其他血管內置入裝置(比如起搏器)。
1.2.8
已發生其他導管相關并發癥,如:導管相關性感染、導管斷裂、導管堵塞、高壓注射至外滲等。
1.3 血管通路選擇
在滿足治療需求的前提下,應選擇外徑最小、管腔數量最少且創傷最小的輸液裝置[5]。
1.4 置管血管選擇
1.4.1
推薦在置管環節使用超聲引導,除提高穿刺成功率、避免反復穿刺外,還可以對血管管徑進行評估。血管應在自然狀態下評估。應根據擬置管血管條件選擇合適的導管型號,建議導管外徑與置管靜脈內徑比值≤45%[6]。
1.4.2
與肘上穿刺部位相比,PICC 及中等長度導管的穿刺點位于肘部及以下時具有更高的 CRT 風險。惡性腫瘤患者經鎖骨下和頸內靜脈長期留置 CVAD 的血栓發生率沒有差異[7]。經鎖骨下靜脈短期留置 CVAD 比經股靜脈置管導致血栓的風險更低,但經頸靜脈和經股靜脈沒有顯著差異[7]。
1.4.3
在四肢置入 CVAD 前和當臨床有指征時,應對上臂(或大腿)周長進行測量并記錄,以利于觀察和發生 DVT 后的病情評估隨訪。測量肘窩上10 cm(或髕骨上緣 15 cm)的周長;評估位置和其他特征,如凹陷性或非凹陷性水腫。
1.4.4
對于在置管前體格檢查發現患者存在雙上肢臂圍不等,單側肢體腫脹,單側肢體、肩部、胸壁靜脈顯露明顯,側支增多時,建議在置管前通過影像學檢查評估患者鎖骨下靜脈、無名靜脈及上腔靜脈是否存在病變,并謹慎選擇置管位置。
1.4.5
考慮到留置導管可能對血管產生的影響,建議所有慢性腎臟病患者(無論是否進入腎病終末期)在留置導管前應向相關專業醫師征詢患者未來血液透析血管通路規劃,并在充分地權衡利弊后決定置管位置和置管類型。
1.5 導管尖端位置
1.5.1
所有 CVAD 的尖端都位于上腔靜脈下三分之一或腔房交界處[8-9]。尖端位置異常的導管應當調整至該位置方可繼續使用。
1.5.2
在同等條件下,理論上中等長度導管尖端位于血流量及血管管腔更大的位置時,血栓風險更低。需要更多的證據綜合評估中等長度導管尖端在不同臨床需求情境下的最佳管尖位置。
1.6 預防性抗凝藥物使用
既往大量隨機對照試驗均未證實藥物在 CRT 預防中的臨床價值,因此目前國際上大多數指南均不推薦以單純預防 CRT 為目的預防性使用抗凝藥物或溶栓藥物[10-13]。目前對細分臨床情境的研究是缺乏的。我們希望有更深入的研究,了解哪些人群更可能從預防性抗凝中獲益。
需要強調的是,CRT 作為 VTE 的一種,其預防不應與患者整體 VTE 預防割裂,尤其考慮到下肢 DVT 可能比 CRT 產生更大的危害。因此對于某些血栓高危患者,盡管指南不推薦以預防 CRT 為目的而采用藥物抗凝,但仍有必要針對 VTE 風險采取相應的預防措施,包括在 VTE 風險較高而出血風險較低時使用藥物預防。可以使用一些成熟的 VTE 風險評估量表進行評估,例如對于惡性腫瘤化療患者使用改良 Khorana 評分(表1)。
1.7 物理預防措施
在情況允許的條件下,鼓勵使用非藥物的措施來預防血栓,包括置入導管的肢體進行早期活動、日常生活的正常活動、適當的肢體鍛煉(如在病情允許情況下反復的松、握拳動作)和補充足夠的水分[5]。
在最后,我們也希望臨床工作人員充分認識到,血栓形成本身也是機體對置入血管內異物(導管)的一種反應,期待通過某種措施使血栓完全不發生,即不現實也無必要。希望臨床工作者在更充分認識 CRT 的基礎上,對于預防血栓有更理性和客觀的思考。
2 診斷方面的建議
2.1 CRT 分類
為了避免過度診斷帶來的過度治療,便于臨床實際應用,以患者的臨床表現作為主要的分類標準,將 CRT 分為以下 4 類。
2.1.1
DVT:置管側肢體、頸部、肩部、胸部和(或)顏面部有水腫癥狀或體征,超聲提示 DVT,伴或不伴淺靜脈、頭臂靜脈(也稱無名靜脈)及上/下腔靜脈血栓形成,伴或不伴受累部位疼痛、皮溫升高、淺表靜脈顯露、頸部或肢體運動障礙、肢體紅斑或麻木感等表現。
2.1.2
血栓性淺靜脈炎:沿置管血管走行方向區域出現的皮膚紅腫疼痛,伴或不伴皮溫升高,查體可觸及條索狀硬結,和(或)超聲提示對應血管血栓形成。
2.1.3
無癥狀血栓:單純影像學發現血栓,但患者無任何主訴癥狀及客觀體征。
2.1.4
血栓性導管失功:由于纖維蛋白鞘、導管內血栓形成或導管尖端血栓形成導致的經導管輸液不暢或完全堵塞。
輔助檢查是診斷的重要參考依據,但輔助檢查應結合患者的癥狀進行綜合判斷,反對單純根據輔助檢查結果而進行的診療。
2.2 影像檢查的建議
2.2.1
多普勒超聲檢查為首要檢查方法[14]。但在有臨床證據證實其價值前,不建議使用超聲無差別地對所有患者進行 CRT 的篩查[15]。
2.2.2
超聲對無名靜脈、腔靜脈等部位的血栓觀察往往不夠確切,宜結合數字減影血管成像(digital subtraction angiography,DSA)或者 CT、MRI 以進一步明確診斷。CT 或 MRI 可以觀察靜脈通暢情況及血栓形成范圍,明確對腔靜脈、髂總靜脈、鎖骨下靜脈和無名靜脈血栓形成的診斷,同時還可發現并存的血管外壓迫因素,如腫瘤、胸廓出口壓迫等,對DVT 的確診和病情的全面了解提供更多信息[16]。
2.2.3
對于以下情況,我們建議進一步行胸部增強 CT 等影像學檢查明確病因,以輔助后續診療決策:① 非導管正常路徑范圍內的血栓,如 PICC 置管患者出現頸內靜脈血栓,需通過影像學檢查明確是否有導管異位,或其他病變導致血栓形成;② 血栓范圍較廣,例如累及鎖骨下靜脈近心端,需準確評估血栓范圍,并明確是否由原發或繼發上腔靜脈狹窄所導致[17];③ 患者癥狀及體征與超聲檢查結果不相符,需要進一步檢查明確。
2.2.4
不建議對診斷為 CRT 的患者,無差別地進行胸部增強 CT 及肺動脈三維重建(CTPA)用以明確是否合并肺栓塞。
2.2.5
除擬后續采用腔內處理手段處理,不建議 常規對患者行靜脈造影檢查。
2.3 血液學檢查的建議
2.3.1
D 二聚體是纖維蛋白原降解產物中的一種,其陰性結果對血栓性疾病的排除有參考價值,但 D 二聚體對 CRT 的診斷價值有限[10, 18],其水平不能作為是否置管的依據,不能作為是否預防性給予抗凝藥物的依據[18]。
2.3.2
對于 CRT,由于其早期血栓量較少,D 二聚體陰性不具排除意義[18]。D 二聚體的影響因素眾多,近期手術、感染、惡性腫瘤、妊娠等因素均可能導致其升高,且有研究表明高齡患者 D 二聚體的正常值范圍需相應上調[19],因而其陽性不具有診斷意義。
2.3.3
對于已診斷導管相關 DVT 的患者,建議檢測 D 二聚體并隨訪其變化,用以輔助對病情發展的評估[20]。但由于臨床證據的缺失,不對 D 二聚體在其他類型 CRT 中的價值和意義進行建議。
2.3.4
血常規及凝血功能的檢查對于疾病的診斷價值可能有限,但在評估出血風險、監測治療效果等方面有著重要意義。
2.3.5
建議對于診斷 CRT 并擬進行抗凝、溶栓治療的患者,應檢查并隨訪血常規及凝血功能,以評估治療的安全性,并為部分藥物效果評估提供依據。對于非住院患者,護士應制定相應的隨訪計劃,并監督其實施。
2.3.6
對于化療患者,需警惕化療相關的血小板減少;對于使用肝素類制品的患者,隨訪也有助于發現肝素相關的血小板減少。對于口服華法林的患者,護理人員必須向患者和(或)其長期照護者宣傳監測凝血酶原時 間國際標準化比值(international normalized ratio,INR)的重要意義,并為患者制定相關的隨訪計劃。
3 導管拔除與否的選擇與時機的建議
3.1 導管拔除與否的選擇原則
3.1.1
目前指南均不推薦在發生血栓后常規拔除導管[5, 11, 13]。
3.1.2
考慮到 CRT 與導管的密切關系,拔除導管最有利于血栓的完全溶解。但如若患者治療仍然需要使用導管,拔除導管后另選部位新置入的導管會有高達 86% 的風險出現新發部位的 CRT[21],因此對仍有使用導管需要的患者,拔除導管毫無意義。
3.1.3
如果患者治療仍然需要該導管通路,可在抗凝治療下繼續保留導管,并正常用于臨床治療[5, 11, 22]。
3.2 拔管指征
目前公認的拔管指征有:治療已不需要該導管;導管功能已喪失;導管位置異常;合并導管相關血流性感染[5, 23]。
3.2.1
導管相關血流性感染和 CRT 有著復雜的關系,它們可能同時發生,也可以互為因果。感染可能啟動血栓形成機制,而已形成的血栓或纖維蛋白鞘又為微生物黏附提供了良好的平臺和庇護所。因此對 CRT 患者,若有癥狀提示,應注意排除有無導管相關血流性感染[24]。
3.2.2
當患者合并抗凝禁忌,或在規范抗凝治療下癥狀仍持續進展也需要考慮拔管。但在臨床實際工作中,這些情況下是否拔管,還需要評估患者的治療對導管使用的依賴程度,以及重新建立靜脈通路的可行性。對于暫時性的抗凝禁忌(例如化療導致的一過性血小板降低),可以采用觀察的方式處理,待抗凝禁忌消失后再行抗凝。而對于導管高度依賴且建立新靜脈通路困難的患者,需要權衡保留導管的價值和血栓帶來的其他潛在風險,在密切觀察隨訪的情況下保留導管是可以考慮的。
3.2.3
血栓形成的范圍與置入導管后局部血流動力學的改變密切相關,使得 CRT 具有一定程度的自限性,對于保留導管之后血栓范圍進一步進展的擔憂,多數情況下是不必要的。
3.3 拔管時機
在拔管的時機選擇上,多認為在接受一段時間抗凝治療之后再拔管有利于血栓的穩定,從而降低拔管時血栓脫落引起肺栓塞的風險[23]。盡管缺乏臨床證據支持這一觀點,我們建議在導管相關的 DVT 急性期抗凝治療 2 周后再考慮拔除導管,則更為安全。
4 不同臨床表現分類 CRT 的護理流程建議
第一版《輸液導管相關靜脈血栓形成中國專家共識》中已經較為詳細地敘述了不同臨床分類導管血栓的處理原則、抗凝治療藥物選擇、療程等內容,本文不再贅述。基于專家共識,我們對護理流程給出以下建議。
4.1 DVT
4.1.1
應對所有置入血管通路裝置(靜脈輸液導管)的患者和(或)長期照護者常規宣教 DVT 的癥狀和體征,包括置管側肢體、頸部、肩部、胸部和(或)顏面部腫脹,伴或不伴受累部位疼痛、皮溫升高、淺表靜脈顯露、頸部或肢體運動障礙等表現,并告知在出現上述表現時應進行報告[5]。
4.1.2
護理人員在使用導管前或在使用間歇期的維護時,應通過病史詢問和查體明確患者是否出現 DVT 的癥狀和體征。
4.1.3
當患者出現疑似 DVT 的癥狀和體征時,應安排患者行超聲檢查以確診。若超聲報告陰性,應請會診或安排其他檢查,明確超聲未涉及部位是否存在病變。
4.1.4
患者經超聲及其他影像學檢查診斷導管相關性 DVT 后,應對患者進行血常規和凝血功能檢查,了解患者已在使用的抗血小板藥物及抗凝藥物情況,測量臂圍,檢查導管的通暢性,評估導管是否有異位或移位,是否合并感染,評估患者后續靜脈治療對導管的依賴性,并請相應科室會診。
4.1.5
若導管通暢性良好且尖端位置無異常,可以繼續使用[10-11]。
4.1.6
對于上肢血管通路裝置繼發的 DVT,通常不需要絕對制動;對于下肢血管通路裝置繼發的 DVT,建議在急性期制動,觀察患者有無咳嗽、咯血、胸悶氣促等肺栓塞癥狀和體征[11]。
4.1.7
建議患者抬高患肢;若患者同時合并血栓性淺靜脈炎,參考血栓性淺靜脈炎進行處理。
4.1.8
遵醫囑給予抗凝治療,并在治療期間觀察患者有無出血癥狀和體征;根據使用的不同藥物要求,定期監測患者實驗室相關指標;觀察有無肺栓塞癥狀和體征;口服華法林患者必須做好患者教育,定期監測 INR;定期觀察并測量血栓側上肢的臂圍及其他癥狀變化,并進行記錄。
4.1.9
護士應參與到 DVT 形成后治療計劃的制定過程,并應向患者和(或)長期照護者說明長期的治療計劃,并設定隨訪計劃。
4.1.10
不建議在血栓急性期的初始階段拔管,除非有立即拔除導管的其他原因,例如合并導管相關的血流性感染或不可復位的導管尖端異位;慢性期拔除導管后應再次超聲檢查評估血管通暢性的恢復狀況,并請相關科室指導后續治療。
4.1.11
為患者和(或)長期照護者提供充分的疾病相關信息,并給予心理支持。
4.2 血栓性淺靜脈炎
4.2.1
血栓性靜脈炎系指靜脈血管內急性非化膿性炎癥同時伴有血栓形成。臨床一般將發生在淺靜脈的血栓性靜脈炎稱為血栓性淺靜脈炎。置入導管的患者在置管靜脈區域出現疼痛、皮膚瘙癢或紅斑等癥狀,伴或不伴觸痛性條索狀結節時,應予以超聲檢查明確診斷,并進行其他相應檢查除外合并感染。
4.2.2
患者經超聲及其他影像學檢查明確有置管靜脈的血栓形成,且血栓僅局限在置管淺靜脈,未累及腋靜脈及其近心端,則診斷為血栓性淺靜脈炎。應對患者進行血常規和凝血檢查,了解患者已在使用的抗血小板及抗凝藥物情況,測量臂圍,檢查導管的通暢性,評估導管是否有異位或移位,是否合并感染,評估患者后續靜脈治療對裝置的依賴性,并請相關科室會診[5]。
4.2.3
若導管通暢性良好且尖端位置無異常,可以繼續使用。
4.2.4
護理人員應根據情況,從下列的措施中選擇部分聯合使用,以幫助患者緩解癥狀,這些措施包括:抬高患肢,50% 硫酸鎂濕熱敷,多磺酸黏多糖乳膏外涂,非甾體類抗炎藥口服或外涂,地奧司明口服,各種類型的濕性敷料如水膠體敷料、水凝膠敷料和軟聚硅酮保濕敷料外貼,傳統醫學治療[25-26]。
4.2.5
遵醫囑給予抗凝治療,并在治療期間觀察患者有無出血癥狀和體征;根據使用的不同藥物的要求,定期監測患者的實驗室相關指標;定期觀察并測量患側上肢癥狀改變情況,并進行記錄。
4.2.6
建議在治療早期或癥狀持續不緩解時復查超聲,對于超聲復查血栓范圍有進展者應請相關科室會診以評估是否需調整治療方案[25, 27]。
4.2.7
指導患者適當加強置管側肢體的功能鍛煉,可有效減少其他并發癥的發生[28]。但應向患者宣教不要進行過于劇烈的活動及按摩。
4.2.8
為患者和(或)長期照護者提供充分的疾病相關信息,并給予心理支持。
4.3 無癥狀血栓
4.3.1
在目前缺乏明確臨床證據支持情況下,不建議對無癥狀患者使用超聲或其他影像學檢查進行血栓的篩查[15]。
4.3.2
對于超聲或其他影像學檢查意外發現的血栓,應對患者進行詳細的病史詢問和體格檢查,若未出現符合其他類別的臨床表現,則歸于無癥狀血栓。
4.3.3
在目前缺乏明確臨床證據支持下,不建議對無癥狀血栓的患者采取包括抗凝在內的積極治療措施,或者包括拔除導管在內的消極處理措施。
4.3.4
呼吁針對無癥狀血栓進行科學的臨床隨訪,并開展相關研究了解其預后。
4.4 血栓性導管失功
導管失功定義為通過血管通路裝置進行輸注和抽血的能力喪失,是導致非計劃性導管拔除的重要原因。引起導管失功的因素包括管腔內的血栓或纖維蛋白鞘/纖維蛋白尾引起的血栓性失功和藥物沉淀或機械原因引起的非血栓性失功[29]。鑒于實際在導管失功時多數情況難以區分血栓性和非血栓性,故本部分給予的建議并不僅針對血栓性導管失功。
4.4.1
護士在使用導管、遵醫囑給藥之前,應了解藥物的性質、給藥方法等。當同時輸注兩種或兩種以上藥物時,應核查藥物是否存在不相容性;如果不確定相容性,應咨詢藥劑師。如果藥物/溶液相互接觸,應檢查發生沉淀的風險。這些藥物包括堿性藥,如苯妥英鈉、地西泮、更昔洛韋、阿昔洛韋、氨芐青霉素、亞胺培南和肝素;酸性藥物,如萬古霉素和腸胃外營養液;頭孢曲松鈉與葡萄糖酸鈣;鈣和磷酸鹽含量增高的腸外營養液內的礦物質沉淀[30-32]。在給予三合一腸外營養溶液時,需警惕脂肪乳劑殘留帶來的導管堵塞風險[31]。
4.4.2
應按照不同血管通路裝置的使用要求,進行正確的沖管/封管操作。每次輸液前用 0.9% 氯化鈉溶液充分地沖洗管路,或更換輸液器。當使用雙腔或三腔導管沖封時應單手同時操作,使雙腔或三腔導管的尖端口壓力相等,避免沖其中的一個管腔時血液進入另一個管腔,導致該管腔堵管的發生。基于無針接頭(即負壓、正壓及恒壓)的類型,應用正確的順序進行導管夾閉和分離注射器,以減少血液回流到導管腔內的血量。
4.4.3
重視在輸注血液制品或經導管抽取血液標本后沖管操作不當導致的導管堵塞風險。
4.4.4
識別導管失功的表現,包括:無法抽回血或血液回流緩慢;輸液速度變緩慢;推注有明顯阻力或無法輸液;電子靜脈輸液泵頻繁堵管報警;在輸液部位發生內滲/外滲或腫脹/滲漏[31, 33]。
4.4.5
對于疑似導管失功的患者,應用 0.9% 氯化鈉溶液進行評估,沖洗每個管腔并嘗試從每個導管腔抽吸回血,確定沖洗和抽吸的容易程度,從而確定導管閉塞的類型(即部分閉塞或完全閉塞)。
4.4.6
如果抽吸沒有血液回流,可以輕輕地注入少量生理鹽水。如果抽吸沒有血液回流但沖管通暢,可以考慮使用 1 mL 或 3 mL 注射器回抽吸出血液。型號較小的注射器在抽血時施加負壓可能增加成功概率。但使用 1 mL 或 3 mL 注射器沖洗會產生高壓,所以不能應用于常規沖封管[34]。
4.4.7
評估可能造成導管堵塞的原因[5, 34]:① 檢查是否存在外部機械原因,諸如導管部位縫合過緊、導管扭曲/夾緊、過濾器或無菌接頭堵塞等。② 根據藥物或溶液的類型、觀察導管或輸液裝置中是否有肉眼可見的沉淀物、既往輸液速度和沖洗頻率,判斷是否與藥物沉積有關。③ 根據導管或附加裝置中肉眼可見的血液、是否近期使用導管抽血等,判斷是否出現血栓性堵塞。④ 必要時應通過影像學檢查、DSA 造影評估是否有夾閉綜合征或 CVAD 異位,DSA 造影對于導管尖端血栓和纖維蛋白鞘有著重要的診斷意義[35]。
4.4.8
對于出現堵塞的導管,需及時采取措施處理;不可因為一個內腔通暢,就對堵塞的另一管腔不予處理[5]。
4.4.9
對于血栓性導管失功,或無法確定原因的導管失功,可以先按血栓性導管失功的方式處理進行溶栓。通過及時給予血栓溶解藥物,恢復靜脈通路裝置的通暢性[34]。
4.4.10
使用單個注射器或三通旋塞法將血栓溶解劑注入到閉塞的腔內。注射器容積不應小于 10 mL。如果可能,應暫時停止所有輸注(特別是如果治療可疑的纖維蛋白鞘),使溶栓劑最大程度和導管內外表面的血栓/纖維蛋白接觸,以便進行最佳溶栓。讓溶栓劑停留 30~120 min,也可根據情況將停留時間延長至 24~72 h。
4.4.11
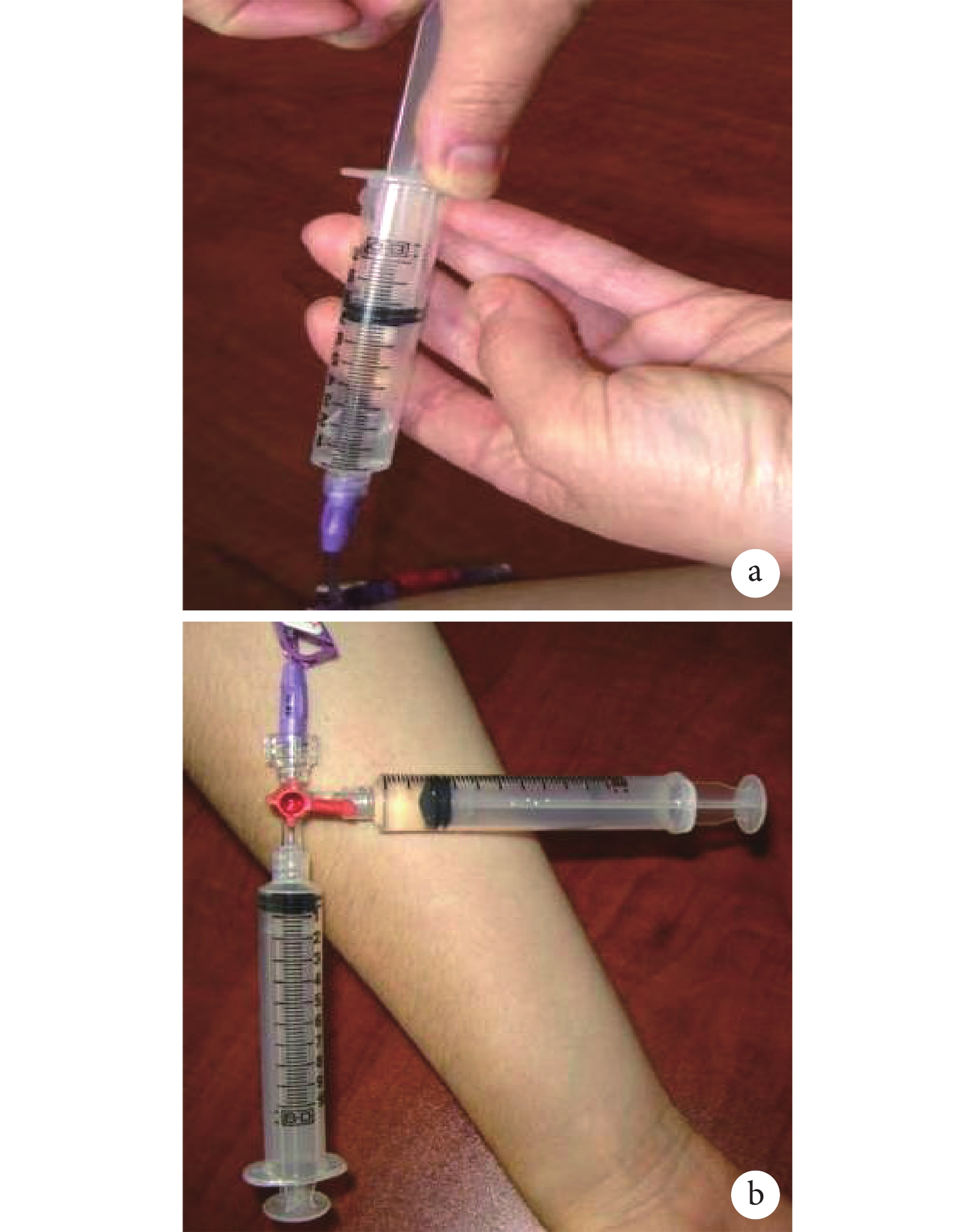
對于部分和完全閉塞的導管,可使用負壓方法。實現負壓有兩種技術,但均應首先要確保含有血栓溶解劑的注射器保持在直立或排盡空氣,以防止空氣進入導管,引起空氣栓塞。① 單注射器技術:使用單個 10 mL 注射器,直接連接到閉塞的 CVAD 管腔(圖1a)。將注射器直立,空氣上升到注射器上部,抽吸的血栓溶解劑保留在注射器底部,通過真空作用,使血栓溶解劑被“吸入”到導管腔內。可以緩慢多次地抽拉針栓,停留一定時間后,回抽出管腔內的溶栓劑,如仍無回血,重復上述步驟,直到可回抽回血。② 三通接頭連接旋轉技術:將三通接頭一端連接到封閉的 CVAD 管腔,另外兩個端口連接空的無菌 10 mL 以上注射器和 10 mL 帶有溶栓劑的注射器(圖1b)。將空注射器的針栓拉回以產生真空,然后將三通旋塞閥旋轉關閉空注射器與導管的連接,打開溶栓注射器,使之與導管相通,通過負壓作用使藥物被“吸”入導管。保留藥物一段時間再回抽,如仍無回血,重復上述步驟,直到可回抽回血。
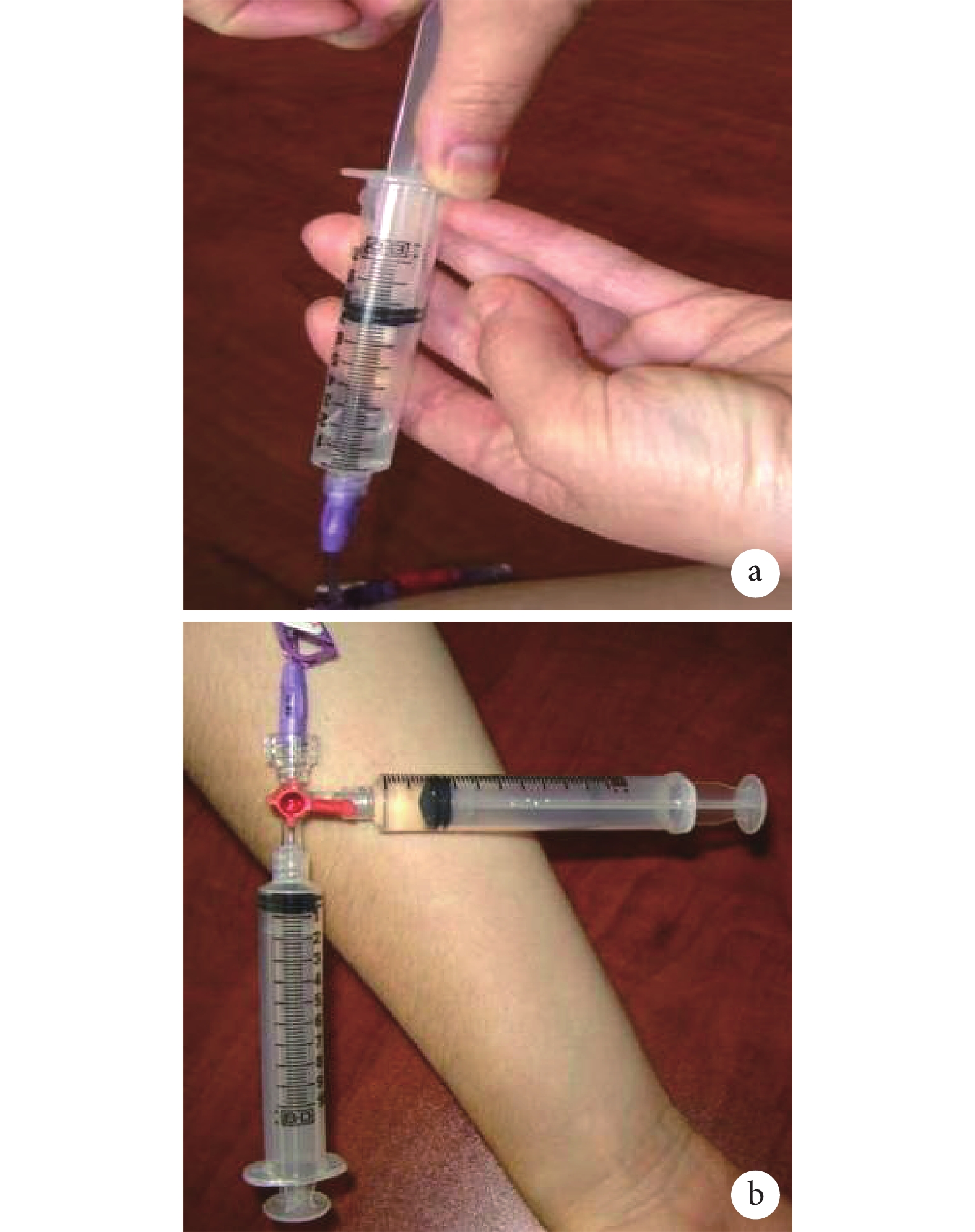 圖1
示實現負壓的兩種技術
圖1
示實現負壓的兩種技術
a:使用單個 10 mL 注射溶栓劑直接滴注溶栓劑,確保含有溶栓劑的注射器保持直立位置,以防止空氣進入導管和血管;b:連接到封閉的 CVAD 管腔的三通旋塞,另外兩個端口連接空的無菌 10 mL 以上注射器和 10 mL 帶有溶栓劑的注射器
4.4.12
當推注溶栓或清除劑(如 70% 乙醇等處理藥物性堵管的溶劑)時,切勿對堵塞的中心血管通路裝置用力過猛,以避免造成對導管的損傷。應采用負壓技術降低導管損壞的風險,并消除腔內殘留液體,使得清除劑能有更多機會充分接觸堵塞物質。
4.4.13
導管復通后、沖洗管腔前應抽吸導管腔內溶解物并丟棄。
4.4.14
如果使用藥物手段不能恢復導管通暢,可考慮其他措施,如轉診到血管外科或介入放射科等具有腔內操作技術的科室,進行進一步處理。
4.4.15
對于無法恢復功能的失功導管,應盡早拔除[5]。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:傅麒寧、吳洲鵬、孫文彥、朱越鋒、何佩儀、齊立行和成芳撰寫文章并參與討論;趙紀春和趙渝指導修改。
隨著靜脈輸液導管,如經外周置入中心靜脈導管(peripherally inserted central catheter,PICC)、輸液港、中長導管等在臨床使用的日益普遍,導管相關靜脈血栓形成(catheter related thrombosis,CRT)作為其常見并發癥日益受到臨床重視。但由于目前國內相當部分醫療機構沒有血管外科作為支撐,在發生 CRT 之后缺乏處置經驗,導致了很多臨床問題。而目前國際指南對該部分內容描述簡單,內容單薄,很多情況下無法指導臨床依此開展工作。在此種背景下,國際血管聯盟中國分會和中國老年醫學學會周圍血管疾病管理分會聯合發起編制了第一版《輸液導管相關靜脈血栓形成中國專家共識》。基于該版專家共識,我們對臨床工作進行以下實踐推薦。由于導管相關領域研究相對較少,高質量研究稀缺,在臨床實踐推薦中我們不對推薦意見進行等級劃分。
1 預防方面的建議
1.1 人員培訓
規范的置管操作,規范使用和維護導管,以及專業的護理團隊是降低包括血栓在內的導管相關并發癥的重要先決條件[1]。我們建議開展靜脈輸液治療相關培訓,并對護士的靜脈輸液治療理論知識和技術能力進行評價與認證,同時應組建專業的靜脈通路管理(或靜脈治療或輸液)團隊[2-3]。
1.2 風險評估
CRT 的發生往往是多個危險因素疊加的結果。合理應用量表進行判斷可能更有價值,但目前臨床上并無公認的量表可以使用。需要考慮的常見危險因素包括但不限于以下情況[3-4]。
1.2.1
有深靜脈血栓(deep venous thrombosis,DVT)病史或家族史(對于有病史的患者應了解其使用抗凝藥物的情況并做充分評估,還需注意藥物引起的出血風險)。
1.2.2
存在導致高凝狀態的慢性疾病,比如惡性腫瘤、腎病綜合征、慢性阻塞性肺病等。
1.2.3
骨科大手術等靜脈血栓栓塞癥(venous thromboembolism,VTE)高危風險手術患者、復合創傷患者及危重患者。
1.2.4
已知存在凝血異常基因,如凝血因子Ⅴ異常或凝血酶原基因突變。
1.2.5
懷孕或者口服避孕藥者。
1.2.6
有多次置入中心靜脈通路裝置(central venous access device,CVAD)的病史,尤其是困難或者損傷性置入史者。
1.2.7
同時存在其他血管內置入裝置(比如起搏器)。
1.2.8
已發生其他導管相關并發癥,如:導管相關性感染、導管斷裂、導管堵塞、高壓注射至外滲等。
1.3 血管通路選擇
在滿足治療需求的前提下,應選擇外徑最小、管腔數量最少且創傷最小的輸液裝置[5]。
1.4 置管血管選擇
1.4.1
推薦在置管環節使用超聲引導,除提高穿刺成功率、避免反復穿刺外,還可以對血管管徑進行評估。血管應在自然狀態下評估。應根據擬置管血管條件選擇合適的導管型號,建議導管外徑與置管靜脈內徑比值≤45%[6]。
1.4.2
與肘上穿刺部位相比,PICC 及中等長度導管的穿刺點位于肘部及以下時具有更高的 CRT 風險。惡性腫瘤患者經鎖骨下和頸內靜脈長期留置 CVAD 的血栓發生率沒有差異[7]。經鎖骨下靜脈短期留置 CVAD 比經股靜脈置管導致血栓的風險更低,但經頸靜脈和經股靜脈沒有顯著差異[7]。
1.4.3
在四肢置入 CVAD 前和當臨床有指征時,應對上臂(或大腿)周長進行測量并記錄,以利于觀察和發生 DVT 后的病情評估隨訪。測量肘窩上10 cm(或髕骨上緣 15 cm)的周長;評估位置和其他特征,如凹陷性或非凹陷性水腫。
1.4.4
對于在置管前體格檢查發現患者存在雙上肢臂圍不等,單側肢體腫脹,單側肢體、肩部、胸壁靜脈顯露明顯,側支增多時,建議在置管前通過影像學檢查評估患者鎖骨下靜脈、無名靜脈及上腔靜脈是否存在病變,并謹慎選擇置管位置。
1.4.5
考慮到留置導管可能對血管產生的影響,建議所有慢性腎臟病患者(無論是否進入腎病終末期)在留置導管前應向相關專業醫師征詢患者未來血液透析血管通路規劃,并在充分地權衡利弊后決定置管位置和置管類型。
1.5 導管尖端位置
1.5.1
所有 CVAD 的尖端都位于上腔靜脈下三分之一或腔房交界處[8-9]。尖端位置異常的導管應當調整至該位置方可繼續使用。
1.5.2
在同等條件下,理論上中等長度導管尖端位于血流量及血管管腔更大的位置時,血栓風險更低。需要更多的證據綜合評估中等長度導管尖端在不同臨床需求情境下的最佳管尖位置。
1.6 預防性抗凝藥物使用
既往大量隨機對照試驗均未證實藥物在 CRT 預防中的臨床價值,因此目前國際上大多數指南均不推薦以單純預防 CRT 為目的預防性使用抗凝藥物或溶栓藥物[10-13]。目前對細分臨床情境的研究是缺乏的。我們希望有更深入的研究,了解哪些人群更可能從預防性抗凝中獲益。
需要強調的是,CRT 作為 VTE 的一種,其預防不應與患者整體 VTE 預防割裂,尤其考慮到下肢 DVT 可能比 CRT 產生更大的危害。因此對于某些血栓高危患者,盡管指南不推薦以預防 CRT 為目的而采用藥物抗凝,但仍有必要針對 VTE 風險采取相應的預防措施,包括在 VTE 風險較高而出血風險較低時使用藥物預防。可以使用一些成熟的 VTE 風險評估量表進行評估,例如對于惡性腫瘤化療患者使用改良 Khorana 評分(表1)。
1.7 物理預防措施
在情況允許的條件下,鼓勵使用非藥物的措施來預防血栓,包括置入導管的肢體進行早期活動、日常生活的正常活動、適當的肢體鍛煉(如在病情允許情況下反復的松、握拳動作)和補充足夠的水分[5]。
在最后,我們也希望臨床工作人員充分認識到,血栓形成本身也是機體對置入血管內異物(導管)的一種反應,期待通過某種措施使血栓完全不發生,即不現實也無必要。希望臨床工作者在更充分認識 CRT 的基礎上,對于預防血栓有更理性和客觀的思考。
2 診斷方面的建議
2.1 CRT 分類
為了避免過度診斷帶來的過度治療,便于臨床實際應用,以患者的臨床表現作為主要的分類標準,將 CRT 分為以下 4 類。
2.1.1
DVT:置管側肢體、頸部、肩部、胸部和(或)顏面部有水腫癥狀或體征,超聲提示 DVT,伴或不伴淺靜脈、頭臂靜脈(也稱無名靜脈)及上/下腔靜脈血栓形成,伴或不伴受累部位疼痛、皮溫升高、淺表靜脈顯露、頸部或肢體運動障礙、肢體紅斑或麻木感等表現。
2.1.2
血栓性淺靜脈炎:沿置管血管走行方向區域出現的皮膚紅腫疼痛,伴或不伴皮溫升高,查體可觸及條索狀硬結,和(或)超聲提示對應血管血栓形成。
2.1.3
無癥狀血栓:單純影像學發現血栓,但患者無任何主訴癥狀及客觀體征。
2.1.4
血栓性導管失功:由于纖維蛋白鞘、導管內血栓形成或導管尖端血栓形成導致的經導管輸液不暢或完全堵塞。
輔助檢查是診斷的重要參考依據,但輔助檢查應結合患者的癥狀進行綜合判斷,反對單純根據輔助檢查結果而進行的診療。
2.2 影像檢查的建議
2.2.1
多普勒超聲檢查為首要檢查方法[14]。但在有臨床證據證實其價值前,不建議使用超聲無差別地對所有患者進行 CRT 的篩查[15]。
2.2.2
超聲對無名靜脈、腔靜脈等部位的血栓觀察往往不夠確切,宜結合數字減影血管成像(digital subtraction angiography,DSA)或者 CT、MRI 以進一步明確診斷。CT 或 MRI 可以觀察靜脈通暢情況及血栓形成范圍,明確對腔靜脈、髂總靜脈、鎖骨下靜脈和無名靜脈血栓形成的診斷,同時還可發現并存的血管外壓迫因素,如腫瘤、胸廓出口壓迫等,對DVT 的確診和病情的全面了解提供更多信息[16]。
2.2.3
對于以下情況,我們建議進一步行胸部增強 CT 等影像學檢查明確病因,以輔助后續診療決策:① 非導管正常路徑范圍內的血栓,如 PICC 置管患者出現頸內靜脈血栓,需通過影像學檢查明確是否有導管異位,或其他病變導致血栓形成;② 血栓范圍較廣,例如累及鎖骨下靜脈近心端,需準確評估血栓范圍,并明確是否由原發或繼發上腔靜脈狹窄所導致[17];③ 患者癥狀及體征與超聲檢查結果不相符,需要進一步檢查明確。
2.2.4
不建議對診斷為 CRT 的患者,無差別地進行胸部增強 CT 及肺動脈三維重建(CTPA)用以明確是否合并肺栓塞。
2.2.5
除擬后續采用腔內處理手段處理,不建議 常規對患者行靜脈造影檢查。
2.3 血液學檢查的建議
2.3.1
D 二聚體是纖維蛋白原降解產物中的一種,其陰性結果對血栓性疾病的排除有參考價值,但 D 二聚體對 CRT 的診斷價值有限[10, 18],其水平不能作為是否置管的依據,不能作為是否預防性給予抗凝藥物的依據[18]。
2.3.2
對于 CRT,由于其早期血栓量較少,D 二聚體陰性不具排除意義[18]。D 二聚體的影響因素眾多,近期手術、感染、惡性腫瘤、妊娠等因素均可能導致其升高,且有研究表明高齡患者 D 二聚體的正常值范圍需相應上調[19],因而其陽性不具有診斷意義。
2.3.3
對于已診斷導管相關 DVT 的患者,建議檢測 D 二聚體并隨訪其變化,用以輔助對病情發展的評估[20]。但由于臨床證據的缺失,不對 D 二聚體在其他類型 CRT 中的價值和意義進行建議。
2.3.4
血常規及凝血功能的檢查對于疾病的診斷價值可能有限,但在評估出血風險、監測治療效果等方面有著重要意義。
2.3.5
建議對于診斷 CRT 并擬進行抗凝、溶栓治療的患者,應檢查并隨訪血常規及凝血功能,以評估治療的安全性,并為部分藥物效果評估提供依據。對于非住院患者,護士應制定相應的隨訪計劃,并監督其實施。
2.3.6
對于化療患者,需警惕化療相關的血小板減少;對于使用肝素類制品的患者,隨訪也有助于發現肝素相關的血小板減少。對于口服華法林的患者,護理人員必須向患者和(或)其長期照護者宣傳監測凝血酶原時 間國際標準化比值(international normalized ratio,INR)的重要意義,并為患者制定相關的隨訪計劃。
3 導管拔除與否的選擇與時機的建議
3.1 導管拔除與否的選擇原則
3.1.1
目前指南均不推薦在發生血栓后常規拔除導管[5, 11, 13]。
3.1.2
考慮到 CRT 與導管的密切關系,拔除導管最有利于血栓的完全溶解。但如若患者治療仍然需要使用導管,拔除導管后另選部位新置入的導管會有高達 86% 的風險出現新發部位的 CRT[21],因此對仍有使用導管需要的患者,拔除導管毫無意義。
3.1.3
如果患者治療仍然需要該導管通路,可在抗凝治療下繼續保留導管,并正常用于臨床治療[5, 11, 22]。
3.2 拔管指征
目前公認的拔管指征有:治療已不需要該導管;導管功能已喪失;導管位置異常;合并導管相關血流性感染[5, 23]。
3.2.1
導管相關血流性感染和 CRT 有著復雜的關系,它們可能同時發生,也可以互為因果。感染可能啟動血栓形成機制,而已形成的血栓或纖維蛋白鞘又為微生物黏附提供了良好的平臺和庇護所。因此對 CRT 患者,若有癥狀提示,應注意排除有無導管相關血流性感染[24]。
3.2.2
當患者合并抗凝禁忌,或在規范抗凝治療下癥狀仍持續進展也需要考慮拔管。但在臨床實際工作中,這些情況下是否拔管,還需要評估患者的治療對導管使用的依賴程度,以及重新建立靜脈通路的可行性。對于暫時性的抗凝禁忌(例如化療導致的一過性血小板降低),可以采用觀察的方式處理,待抗凝禁忌消失后再行抗凝。而對于導管高度依賴且建立新靜脈通路困難的患者,需要權衡保留導管的價值和血栓帶來的其他潛在風險,在密切觀察隨訪的情況下保留導管是可以考慮的。
3.2.3
血栓形成的范圍與置入導管后局部血流動力學的改變密切相關,使得 CRT 具有一定程度的自限性,對于保留導管之后血栓范圍進一步進展的擔憂,多數情況下是不必要的。
3.3 拔管時機
在拔管的時機選擇上,多認為在接受一段時間抗凝治療之后再拔管有利于血栓的穩定,從而降低拔管時血栓脫落引起肺栓塞的風險[23]。盡管缺乏臨床證據支持這一觀點,我們建議在導管相關的 DVT 急性期抗凝治療 2 周后再考慮拔除導管,則更為安全。
4 不同臨床表現分類 CRT 的護理流程建議
第一版《輸液導管相關靜脈血栓形成中國專家共識》中已經較為詳細地敘述了不同臨床分類導管血栓的處理原則、抗凝治療藥物選擇、療程等內容,本文不再贅述。基于專家共識,我們對護理流程給出以下建議。
4.1 DVT
4.1.1
應對所有置入血管通路裝置(靜脈輸液導管)的患者和(或)長期照護者常規宣教 DVT 的癥狀和體征,包括置管側肢體、頸部、肩部、胸部和(或)顏面部腫脹,伴或不伴受累部位疼痛、皮溫升高、淺表靜脈顯露、頸部或肢體運動障礙等表現,并告知在出現上述表現時應進行報告[5]。
4.1.2
護理人員在使用導管前或在使用間歇期的維護時,應通過病史詢問和查體明確患者是否出現 DVT 的癥狀和體征。
4.1.3
當患者出現疑似 DVT 的癥狀和體征時,應安排患者行超聲檢查以確診。若超聲報告陰性,應請會診或安排其他檢查,明確超聲未涉及部位是否存在病變。
4.1.4
患者經超聲及其他影像學檢查診斷導管相關性 DVT 后,應對患者進行血常規和凝血功能檢查,了解患者已在使用的抗血小板藥物及抗凝藥物情況,測量臂圍,檢查導管的通暢性,評估導管是否有異位或移位,是否合并感染,評估患者后續靜脈治療對導管的依賴性,并請相應科室會診。
4.1.5
若導管通暢性良好且尖端位置無異常,可以繼續使用[10-11]。
4.1.6
對于上肢血管通路裝置繼發的 DVT,通常不需要絕對制動;對于下肢血管通路裝置繼發的 DVT,建議在急性期制動,觀察患者有無咳嗽、咯血、胸悶氣促等肺栓塞癥狀和體征[11]。
4.1.7
建議患者抬高患肢;若患者同時合并血栓性淺靜脈炎,參考血栓性淺靜脈炎進行處理。
4.1.8
遵醫囑給予抗凝治療,并在治療期間觀察患者有無出血癥狀和體征;根據使用的不同藥物要求,定期監測患者實驗室相關指標;觀察有無肺栓塞癥狀和體征;口服華法林患者必須做好患者教育,定期監測 INR;定期觀察并測量血栓側上肢的臂圍及其他癥狀變化,并進行記錄。
4.1.9
護士應參與到 DVT 形成后治療計劃的制定過程,并應向患者和(或)長期照護者說明長期的治療計劃,并設定隨訪計劃。
4.1.10
不建議在血栓急性期的初始階段拔管,除非有立即拔除導管的其他原因,例如合并導管相關的血流性感染或不可復位的導管尖端異位;慢性期拔除導管后應再次超聲檢查評估血管通暢性的恢復狀況,并請相關科室指導后續治療。
4.1.11
為患者和(或)長期照護者提供充分的疾病相關信息,并給予心理支持。
4.2 血栓性淺靜脈炎
4.2.1
血栓性靜脈炎系指靜脈血管內急性非化膿性炎癥同時伴有血栓形成。臨床一般將發生在淺靜脈的血栓性靜脈炎稱為血栓性淺靜脈炎。置入導管的患者在置管靜脈區域出現疼痛、皮膚瘙癢或紅斑等癥狀,伴或不伴觸痛性條索狀結節時,應予以超聲檢查明確診斷,并進行其他相應檢查除外合并感染。
4.2.2
患者經超聲及其他影像學檢查明確有置管靜脈的血栓形成,且血栓僅局限在置管淺靜脈,未累及腋靜脈及其近心端,則診斷為血栓性淺靜脈炎。應對患者進行血常規和凝血檢查,了解患者已在使用的抗血小板及抗凝藥物情況,測量臂圍,檢查導管的通暢性,評估導管是否有異位或移位,是否合并感染,評估患者后續靜脈治療對裝置的依賴性,并請相關科室會診[5]。
4.2.3
若導管通暢性良好且尖端位置無異常,可以繼續使用。
4.2.4
護理人員應根據情況,從下列的措施中選擇部分聯合使用,以幫助患者緩解癥狀,這些措施包括:抬高患肢,50% 硫酸鎂濕熱敷,多磺酸黏多糖乳膏外涂,非甾體類抗炎藥口服或外涂,地奧司明口服,各種類型的濕性敷料如水膠體敷料、水凝膠敷料和軟聚硅酮保濕敷料外貼,傳統醫學治療[25-26]。
4.2.5
遵醫囑給予抗凝治療,并在治療期間觀察患者有無出血癥狀和體征;根據使用的不同藥物的要求,定期監測患者的實驗室相關指標;定期觀察并測量患側上肢癥狀改變情況,并進行記錄。
4.2.6
建議在治療早期或癥狀持續不緩解時復查超聲,對于超聲復查血栓范圍有進展者應請相關科室會診以評估是否需調整治療方案[25, 27]。
4.2.7
指導患者適當加強置管側肢體的功能鍛煉,可有效減少其他并發癥的發生[28]。但應向患者宣教不要進行過于劇烈的活動及按摩。
4.2.8
為患者和(或)長期照護者提供充分的疾病相關信息,并給予心理支持。
4.3 無癥狀血栓
4.3.1
在目前缺乏明確臨床證據支持情況下,不建議對無癥狀患者使用超聲或其他影像學檢查進行血栓的篩查[15]。
4.3.2
對于超聲或其他影像學檢查意外發現的血栓,應對患者進行詳細的病史詢問和體格檢查,若未出現符合其他類別的臨床表現,則歸于無癥狀血栓。
4.3.3
在目前缺乏明確臨床證據支持下,不建議對無癥狀血栓的患者采取包括抗凝在內的積極治療措施,或者包括拔除導管在內的消極處理措施。
4.3.4
呼吁針對無癥狀血栓進行科學的臨床隨訪,并開展相關研究了解其預后。
4.4 血栓性導管失功
導管失功定義為通過血管通路裝置進行輸注和抽血的能力喪失,是導致非計劃性導管拔除的重要原因。引起導管失功的因素包括管腔內的血栓或纖維蛋白鞘/纖維蛋白尾引起的血栓性失功和藥物沉淀或機械原因引起的非血栓性失功[29]。鑒于實際在導管失功時多數情況難以區分血栓性和非血栓性,故本部分給予的建議并不僅針對血栓性導管失功。
4.4.1
護士在使用導管、遵醫囑給藥之前,應了解藥物的性質、給藥方法等。當同時輸注兩種或兩種以上藥物時,應核查藥物是否存在不相容性;如果不確定相容性,應咨詢藥劑師。如果藥物/溶液相互接觸,應檢查發生沉淀的風險。這些藥物包括堿性藥,如苯妥英鈉、地西泮、更昔洛韋、阿昔洛韋、氨芐青霉素、亞胺培南和肝素;酸性藥物,如萬古霉素和腸胃外營養液;頭孢曲松鈉與葡萄糖酸鈣;鈣和磷酸鹽含量增高的腸外營養液內的礦物質沉淀[30-32]。在給予三合一腸外營養溶液時,需警惕脂肪乳劑殘留帶來的導管堵塞風險[31]。
4.4.2
應按照不同血管通路裝置的使用要求,進行正確的沖管/封管操作。每次輸液前用 0.9% 氯化鈉溶液充分地沖洗管路,或更換輸液器。當使用雙腔或三腔導管沖封時應單手同時操作,使雙腔或三腔導管的尖端口壓力相等,避免沖其中的一個管腔時血液進入另一個管腔,導致該管腔堵管的發生。基于無針接頭(即負壓、正壓及恒壓)的類型,應用正確的順序進行導管夾閉和分離注射器,以減少血液回流到導管腔內的血量。
4.4.3
重視在輸注血液制品或經導管抽取血液標本后沖管操作不當導致的導管堵塞風險。
4.4.4
識別導管失功的表現,包括:無法抽回血或血液回流緩慢;輸液速度變緩慢;推注有明顯阻力或無法輸液;電子靜脈輸液泵頻繁堵管報警;在輸液部位發生內滲/外滲或腫脹/滲漏[31, 33]。
4.4.5
對于疑似導管失功的患者,應用 0.9% 氯化鈉溶液進行評估,沖洗每個管腔并嘗試從每個導管腔抽吸回血,確定沖洗和抽吸的容易程度,從而確定導管閉塞的類型(即部分閉塞或完全閉塞)。
4.4.6
如果抽吸沒有血液回流,可以輕輕地注入少量生理鹽水。如果抽吸沒有血液回流但沖管通暢,可以考慮使用 1 mL 或 3 mL 注射器回抽吸出血液。型號較小的注射器在抽血時施加負壓可能增加成功概率。但使用 1 mL 或 3 mL 注射器沖洗會產生高壓,所以不能應用于常規沖封管[34]。
4.4.7
評估可能造成導管堵塞的原因[5, 34]:① 檢查是否存在外部機械原因,諸如導管部位縫合過緊、導管扭曲/夾緊、過濾器或無菌接頭堵塞等。② 根據藥物或溶液的類型、觀察導管或輸液裝置中是否有肉眼可見的沉淀物、既往輸液速度和沖洗頻率,判斷是否與藥物沉積有關。③ 根據導管或附加裝置中肉眼可見的血液、是否近期使用導管抽血等,判斷是否出現血栓性堵塞。④ 必要時應通過影像學檢查、DSA 造影評估是否有夾閉綜合征或 CVAD 異位,DSA 造影對于導管尖端血栓和纖維蛋白鞘有著重要的診斷意義[35]。
4.4.8
對于出現堵塞的導管,需及時采取措施處理;不可因為一個內腔通暢,就對堵塞的另一管腔不予處理[5]。
4.4.9
對于血栓性導管失功,或無法確定原因的導管失功,可以先按血栓性導管失功的方式處理進行溶栓。通過及時給予血栓溶解藥物,恢復靜脈通路裝置的通暢性[34]。
4.4.10
使用單個注射器或三通旋塞法將血栓溶解劑注入到閉塞的腔內。注射器容積不應小于 10 mL。如果可能,應暫時停止所有輸注(特別是如果治療可疑的纖維蛋白鞘),使溶栓劑最大程度和導管內外表面的血栓/纖維蛋白接觸,以便進行最佳溶栓。讓溶栓劑停留 30~120 min,也可根據情況將停留時間延長至 24~72 h。
4.4.11
對于部分和完全閉塞的導管,可使用負壓方法。實現負壓有兩種技術,但均應首先要確保含有血栓溶解劑的注射器保持在直立或排盡空氣,以防止空氣進入導管,引起空氣栓塞。① 單注射器技術:使用單個 10 mL 注射器,直接連接到閉塞的 CVAD 管腔(圖1a)。將注射器直立,空氣上升到注射器上部,抽吸的血栓溶解劑保留在注射器底部,通過真空作用,使血栓溶解劑被“吸入”到導管腔內。可以緩慢多次地抽拉針栓,停留一定時間后,回抽出管腔內的溶栓劑,如仍無回血,重復上述步驟,直到可回抽回血。② 三通接頭連接旋轉技術:將三通接頭一端連接到封閉的 CVAD 管腔,另外兩個端口連接空的無菌 10 mL 以上注射器和 10 mL 帶有溶栓劑的注射器(圖1b)。將空注射器的針栓拉回以產生真空,然后將三通旋塞閥旋轉關閉空注射器與導管的連接,打開溶栓注射器,使之與導管相通,通過負壓作用使藥物被“吸”入導管。保留藥物一段時間再回抽,如仍無回血,重復上述步驟,直到可回抽回血。
 圖1
示實現負壓的兩種技術
圖1
示實現負壓的兩種技術
a:使用單個 10 mL 注射溶栓劑直接滴注溶栓劑,確保含有溶栓劑的注射器保持直立位置,以防止空氣進入導管和血管;b:連接到封閉的 CVAD 管腔的三通旋塞,另外兩個端口連接空的無菌 10 mL 以上注射器和 10 mL 帶有溶栓劑的注射器
4.4.12
當推注溶栓或清除劑(如 70% 乙醇等處理藥物性堵管的溶劑)時,切勿對堵塞的中心血管通路裝置用力過猛,以避免造成對導管的損傷。應采用負壓技術降低導管損壞的風險,并消除腔內殘留液體,使得清除劑能有更多機會充分接觸堵塞物質。
4.4.13
導管復通后、沖洗管腔前應抽吸導管腔內溶解物并丟棄。
4.4.14
如果使用藥物手段不能恢復導管通暢,可考慮其他措施,如轉診到血管外科或介入放射科等具有腔內操作技術的科室,進行進一步處理。
4.4.15
對于無法恢復功能的失功導管,應盡早拔除[5]。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:傅麒寧、吳洲鵬、孫文彥、朱越鋒、何佩儀、齊立行和成芳撰寫文章并參與討論;趙紀春和趙渝指導修改。