Leber遺傳性視神經病變(LHON)是一種典型的母系遺傳性眼病,主要累及視網膜和鞏膜篩板前部視盤黃斑束纖維,且具有男性高發及不完全外顯的特點。該病以線粒體DNA原發突變m.11778G>A、m.14484T>C和m.3460G>A為致病分子基礎,同時存在其他風險因素共同作用影響其表型表達,如線粒體DNA繼發突變、線粒體單倍體型、核修飾基因、雌激素、維生素B12和環境因素等。目前LHON的分子診斷主要聚焦于線粒體DNA原發突變位點的檢測,存在相對局限性,因此綜合解析多種風險因素,構建多維度的疾病預防和診療系統,為患者提供精準化和個體化醫療服務,將為減緩LHON疾病進程和降低發病率起到重要作用,也為LHON發病機制的不同角度深入研究和臨床干預策略提供新思路。
引用本文: 高應龍, 俞佳玲. Leber遺傳性視神經病變中風險因素的研究進展. 中華眼底病雜志, 2023, 39(7): 600-604. doi: 10.3760/cma.j.cn511434-20220829-00480 復制
Leber遺傳性視神經病變(LHON)是一種導致視神經變性的母系遺傳性眼病(即母系后代發病而父系后代不發病),主要累及視網膜和鞏膜篩板前部視盤黃斑束纖維,高發于15~35歲男性。臨床上主要表現為雙眼同時或先后急性或亞急性無痛性視力減退,可同時伴有中心視野缺失及色覺障礙,視力可在2年內漸進性下降,也可突然完全喪失[1]。視網膜神經節細胞(RGC)受損是該病的主要病理學特征[2]。線粒體DNA(mtDNA)原發突變m.11778G>A、m.14484T>C和m.3460G>A是引起LHON發病的分子基礎,但線粒體基因、核基因、雌激素、維生素B12及環境因素等在LHON的發生發展中也發揮著協同作用。現就LHON相關的修飾因素及最新的研究進展作一綜述,以期為LHON疾病的研究提供參考。
1 線粒體基因
1.1 繼發突變位點
協同原發突變位點增加LHON臨床表型的一些mtDNA突變位點被稱為繼發突變。這些繼發突變位點也可見于表型正常的人群中。
線粒體轉運RNA(tRNA)基因突變是LHON繼發突變的研究熱點,也與其他線粒體疾病如耳聾、高血壓、心血管疾病、腎病等相關[3-5]。線粒體tRNAMet 4435G>A、tRNAAla 5587T>C、tRNAThr 15927G>A以及15951A>G均被證實是LHON相關的tRNA突變[6-7]。Ji等[8]對811例LHON患者的線粒體tRNA突變位點進行篩查,發現了32個LHON相關的變異位點可能參與到LHON的發病分子機制中,如位于受體臂的突變tRNAPhe 644A>G(U70)、tRNALys 8297C > T(C3)、tRNAGly 10055A>G(U70)、tRNAHis 12141A>G(A4)、tRNAThr 15949G>A(G59)等;或位于tRNA反密碼子臂的突變tRNATrp 5539A>G(A29)、tRNACys 5802T>C(U30)和tRNASer(AGY)12223A>G(A31)[8]。線粒體tRNA變異位點可能會影響tRNA的二級結構和功能,導致線粒體tRNA代謝異常,進而影響線粒體編碼蛋白的合成,從而加劇由原發突變位點引起的線粒體功能障礙,增加LHON的外顯率。
此外,編碼線粒體復合體Ⅰ的蛋白亞基如ND1、ND4、ND6也存在著大量與LHON相關的繼發突變位點,如ND1 m.3394T>C、m.3497C>T、m.3571C>T,ND4 m.11696G>A、ND5 m.12338T>C和ND6 m.14502T>C突變,可增加由m.11778G>A突變所致的LHON的臨床表型[9-13]。利用胞質雜合細胞模型研究發現,繼發位點協同原發突變影響線粒體復合體Ⅰ的組裝和結構的穩定性,降低酶活力,從而增加攜帶原發突變m.11778G>A的患病風險[6]。
1.2 線粒體單倍體型
有研究認為,線粒體單倍體型與LHON存在一定的相關性[14-16]。單倍體型代表人類mtDNA進化樹的分支,而這些分支可以由mtDNA的多態性位點進行描述。多個相互獨立的隊列研究發現,在歐洲LHON患者中,線粒體單倍體型J與m.11778G>A及m.14484T>C存在一定的相關性,其中線粒體單倍體型J2和J1分別增加了攜帶m.11778G>A和m.14484T>C人群的LHON發病風險[14-16]。線粒體單倍體型K增加攜帶m.3460G>A人群的LHON患病風險[14]。而單倍體型H被認為可降低攜帶m.11778G>A突變的人群患LHON的風險[14]。
在東亞LHON人群研究中,并沒有發現單倍體型J與LHON的相關性,中國人群中,單倍體型M7b似乎能增加攜帶m.11778G>A突變家系成員的外顯率,而單倍體型M8a和F則降低LHON的外顯率[17-18]。另有研究表明,單倍體型M9、M10和N9可增加中國人群中攜帶m.14484T>C突變LHON家系的外顯率及表現度[19]。
線粒體單倍體型增加LHON的發病風險,可能與單倍體型上的特征性變異相關。例如,有功能研究顯示,J1和J2這兩個單倍體亞型中的4216T>C變異會降低煙酰胺腺嘌呤二核苷酸脫氫酶的活力,并可能影響線粒體復合體Ⅰ的結構穩定性[20]。M7b上的特征變異位點m.12811T>C在多篇文獻中被報道為繼發突變位點[21-22]。這說明這些單倍體型上的特征性變異位點可導致溫和的線粒體功能障礙,并協同原發突變位點達到線粒體損傷閾值,增加LHON的外顯率及表現度。
2 核修飾基因
LHON的不完全外顯和男性多發的特征,提示核基因對LHON發病有重要的調控功能。1992年,Bu和Rotter[23]對LHON的家系數據進行了“雙基因假說”的分析,發現X染色體連鎖的相關基因在LHON中具有較高的關聯性。2010年,一項對泰國LHON家系的全基因組連鎖分析研究結果顯示,LHON不僅僅與X染色體存在著中等程度的關聯,也與1、3、12、13、18號常染色體存在著中等程度的聯系[24]。與LHON相關的核修飾基因鮮有報道,目前僅報道了2個與LHON相關的核修飾基因YARS2及PRICKLE3,并對LHON的致病機制進行了深入的探索。
2.1 YARS2
YARS2基因編碼線粒體酪氨酰-tRNA合成酶,催化線粒體中的酪氨酸與tRNATyr通過酯化反應形成Tyr-tRNATyr,參與線粒體編碼蛋白的翻譯過程。Jiang等[25]在攜帶m.11778G>A的LHON家系中發現并鑒定了YARS2(c.572G>T,p.191Gly>Val)為LHON相關的核修飾基因。YARS2 c.572G>T突變造成tRNATyr氨酰化效率和tRNATyr穩態水平降低,導致線粒體編碼蛋白的翻譯水平出現障礙,從而加劇線粒體功能障礙,如復合體Ⅰ及復合體Ⅳ酶活力降低、三磷酸腺苷(ATP)合成減少、活性氧(ROS)產量增加,從而增加LHON的外顯率[25]。隨后,Jin等[26]在攜帶m.3635G>A的LHON家系中也篩查到該突變位點,并在攜帶m.3635G>A和YARS2 c.572G>T的LHON患者來源的永生化淋巴細胞系模型中進行功能驗證,結果進一步證實了YARS2是LHON相關的核修飾基因。YARS2除具有酪氨酰-tRNA合成酶的功能外,還參與線粒體復合體Ⅰ及復合體Ⅳ的組裝[27]。
2.2 PRICKLE3
PRICKLE3是平板細胞極性核心組分PRICKLE家族中的一員[28-29]。Yu等[30]在一個攜帶m.11778G>A突變的LHON家系中首次發現并鑒定了LHON相關的X-連鎖核修飾基因PRICKLE3(c.157C>T, p.Arg53Trp)。該基因位于Xp11.23,位于預測的LHON相關修飾基因的熱點區段,PRICKLE3的發現可以解釋部分LHON家系中男性高發的特點。研究發現,PRICKLE3與ATP合酶上的ATP6存在相互作用,參與線粒體ATP合酶的組裝[30]。PRICKLE3表達降低會導致完整組裝的ATP合酶減少,復合體Ⅴ酶活力降低,從而影響ATP的產生。這一現象在攜帶PRICKLE3 c.157C>T突變的LHON患者來源的淋巴細胞中得到了證實。因此,PRICKLE3c.157C>T突變協同m.11778G>A,加劇線粒體氧化磷酸化的功能障礙,導致ATP合成減少[30]。
LHON的發病具有組織特異性,RGC及其軸突特異性減少是LHON的主要特征[2]。最近,Nie等[31]利用多能誘導干細胞(iPSC)技術,將患者來源的成纖維細胞誘導為iPSC并定向分化RGC。結果顯示,攜帶PRICKLE3 c.157C>T及m.11778G>A雙突變的類RGC細胞會導致更為嚴重的線粒體功能障礙:如ATP產量顯著降低、RGC形態及電生理較對照組顯著變化、RGC凋亡比例顯著高于對照組等,說明PRICKLE3基因突變在RGC中導致能量代謝的紊亂并會增加RGC的凋亡[31]。
3 其他因素
3.1 雌激素
男性與女性間荷爾蒙的差異也被認為可能是LHON男性發病率較高的原因。女性中,雌激素被認為能夠改善線粒體的功能障礙。在攜帶LHON原發突變位點的細胞系中,加入17β-雌二醇可激活線粒體的生物發生、增強超氧化物歧化酶2的活性并降低ROS產生,減少細胞凋亡[32]。雌激素β受體在RGC的軸突中表達尤為豐富[32]。Pisano等[33]研究發現,雌激素β受體定位于線粒體上,在攜帶m.11778G>A的胞質雜合細胞模型中,加入雌激素β受體特異性結合的天然雌激素可減少細胞凋亡、誘導線粒體生物發生和降低LHON細胞中ROS產量,從而提高細胞的存活力。這些數據都顯示了雌激素在LHON的發病過程中具有一定的保護作用。
3.2 維生素B12
維生素B12對DNA合成非常重要,是兩個重要酶反應的輔因子:一個是位于線粒體上的甲基丙二酰輔酶a變位酶,可催化甲基丙二酰輔酶a轉化為琥珀酰輔酶a[34];另一個是位于細胞質的甲硫氨酸合成酶,依賴于5-甲基鈷胺和5-甲基四氫葉酸,催化同型半胱氨酸轉化為甲硫氨酸[35]。有研究認為,維生素B12缺乏會影響線粒體功能和氧化代謝,引起視神經營養不足,導致視力損傷[36]。因此,缺乏維生素B12引起的視神經病變與LHON具有相同的病理生理特征和相似的臨床表現。Zibold等[37]對攜帶LHON原發突變位點的244例患者進行維生素B12缺乏的相關研究,結果顯示,在所有年齡組中,LHON突變攜帶者的維生素B12缺乏癥患病率高于普通人群。雖然維生素B12缺乏在LHON患者和無癥狀突變攜帶者之間的患病率沒有統計學差異,但其臨床相關因素(如多神經病變)在LHON患者組中更為常見。
3.3 環境因素
吸煙和酗酒是導致LHON發病的兩個重要環境因素因素。125個歐洲LHON家系的回顧性研究顯示,吸煙與視力損傷存在著密切的聯系,相較于吸煙不多的LHON家系成員,吸煙頻次更高的成員發病比例更高[38]。研究結果顯示,該人群中男性吸煙者的外顯率為93%,而非吸煙者的外顯率為66%[38]。吸煙會減少mtDNA拷貝數、降低線粒體復合體Ⅰ酶活性和細胞色素c活力,增加ROS的產生[38]。巴西-意大利的39個LHON家系成員與吸煙相關性的研究中也發現吸煙會減少線粒體的拷貝數[39]。將患者、無癥狀攜帶者以及對照個體的白細胞或纖維母細胞暴露于香煙煙霧濃縮器中發現,所有的細胞都表現出mtDNA拷貝數降低,而ATP水平的降低僅在攜帶原發突變位點細胞中出現(包括攜帶者)。無癥狀的攜帶者中存在一個補償機制,可以增加mtDNA拷貝數,清除更多的ROS,而吸煙者由于煙霧中的毒性,降低了這一補償機制,加劇線粒體功能障礙,導致視力受損[40]。
重度酗酒也被認為與LHON的發病存在一定的聯系,但其影響不如吸煙對LHON產生的影響顯著[41]。
其他的環境因素的影響,包括頭部創傷、食物中有害毒物的攝取、工業毒害、線粒體毒性藥物的使用,如抗逆轉錄病毒藥物以及乙胺丁醇也會增加LHON的外顯率和表現度[42-45]。
4 展望
mtDNA繼發突變、線粒體單倍體型、核修飾基因、雌激素、維生素B12和環境因素是LHON的風險因素(圖1)。目前LHON的臨床研究主要局限于線粒體原發突變位點,且致病機理的研究模型僅為永生化淋巴細胞系和轉線粒體細胞系,缺乏組織特異性的細胞模型和mtDNA突變的動物模型。隨著基因測序技術的發展,新的繼發突變位點和核修飾基因正不斷被發現,LHON的各種風險因素也獲得越來越多的關注。隨著iPSC技術、CRISPR/Cas9和Mito-TALEN等基因編輯技術的發展,把患者來源的細胞重編程為視網膜神經節細胞模型,以及構建mtDNA突變的動物模型,將為線粒體原發突變位點和各種風險因素的致病機理的深入研究提供強有力的技術支撐。相信依靠大數據的深入挖掘和科研成果的不斷積累,會建立起更全面的原發突變位點和多種風險因素相結合的多維度精準化預防診療體系,實現LHON疾病的個體化預防和精準診治。
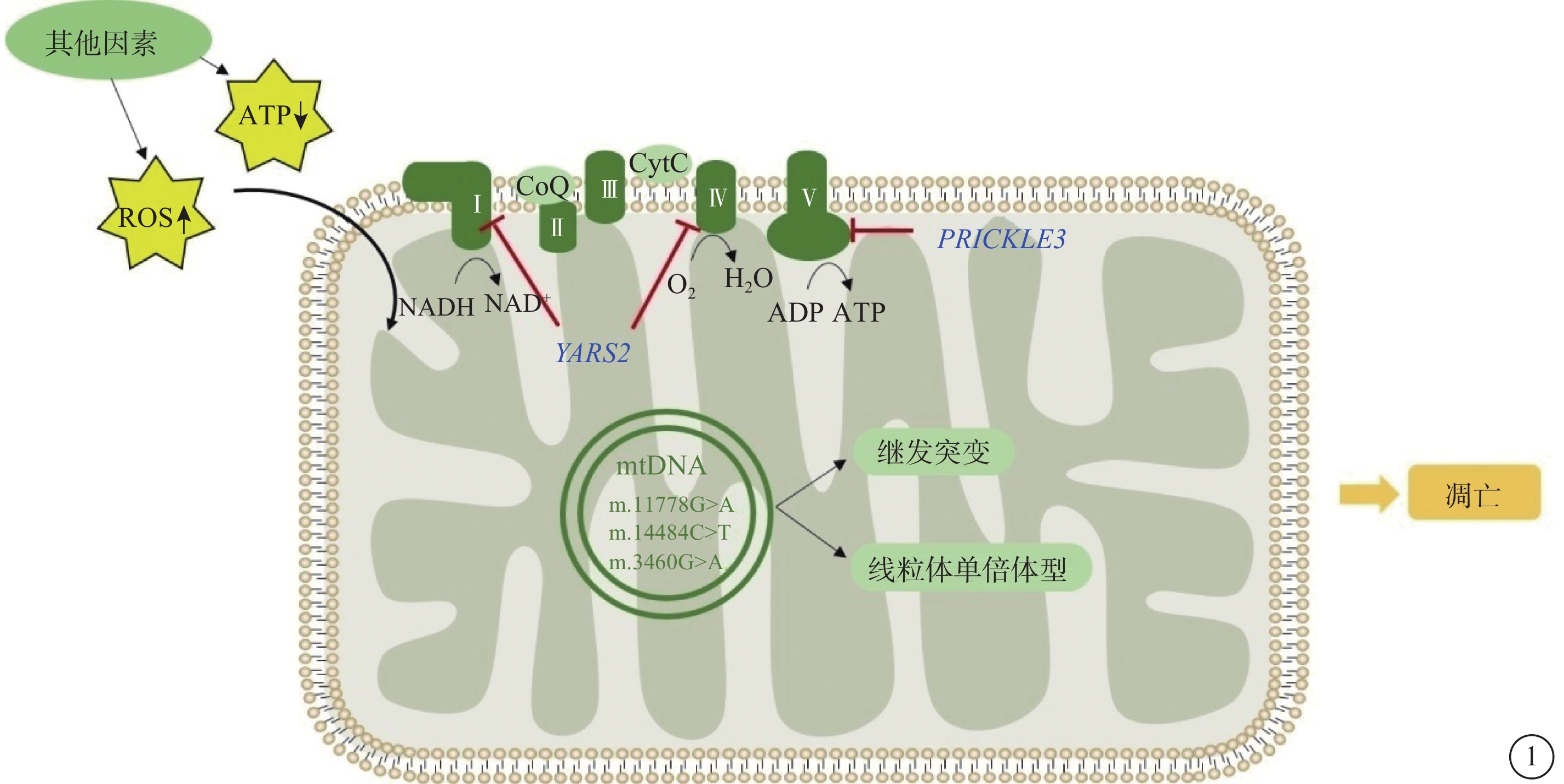
 圖1
LHON的分子致病機理 LHON:Leber遺傳性視神經病變;ATP:三磷酸腺苷;ROS:活性氧;NADH:煙酰胺腺嘌呤二核苷酸還原態;NAD+:煙酰胺腺嘌呤二核苷酸氧化態;ADP:二磷酸腺苷;CoQ:輔酶Q;CytC:細胞色素C。線粒體原發位點突變m.11778G>A、m.14484T>C和m.3460G>A是LHON發病的分子基礎,諸多風險因素如線粒體繼發突變位點、線粒體單倍體型、核修飾基因及其他因素主要加劇線粒體呼吸鏈功能障礙,導致線粒體ATP合成減少、ROS生成增多,最終誘發細胞凋亡
圖1
LHON的分子致病機理 LHON:Leber遺傳性視神經病變;ATP:三磷酸腺苷;ROS:活性氧;NADH:煙酰胺腺嘌呤二核苷酸還原態;NAD+:煙酰胺腺嘌呤二核苷酸氧化態;ADP:二磷酸腺苷;CoQ:輔酶Q;CytC:細胞色素C。線粒體原發位點突變m.11778G>A、m.14484T>C和m.3460G>A是LHON發病的分子基礎,諸多風險因素如線粒體繼發突變位點、線粒體單倍體型、核修飾基因及其他因素主要加劇線粒體呼吸鏈功能障礙,導致線粒體ATP合成減少、ROS生成增多,最終誘發細胞凋亡
Leber遺傳性視神經病變(LHON)是一種導致視神經變性的母系遺傳性眼病(即母系后代發病而父系后代不發病),主要累及視網膜和鞏膜篩板前部視盤黃斑束纖維,高發于15~35歲男性。臨床上主要表現為雙眼同時或先后急性或亞急性無痛性視力減退,可同時伴有中心視野缺失及色覺障礙,視力可在2年內漸進性下降,也可突然完全喪失[1]。視網膜神經節細胞(RGC)受損是該病的主要病理學特征[2]。線粒體DNA(mtDNA)原發突變m.11778G>A、m.14484T>C和m.3460G>A是引起LHON發病的分子基礎,但線粒體基因、核基因、雌激素、維生素B12及環境因素等在LHON的發生發展中也發揮著協同作用。現就LHON相關的修飾因素及最新的研究進展作一綜述,以期為LHON疾病的研究提供參考。
1 線粒體基因
1.1 繼發突變位點
協同原發突變位點增加LHON臨床表型的一些mtDNA突變位點被稱為繼發突變。這些繼發突變位點也可見于表型正常的人群中。
線粒體轉運RNA(tRNA)基因突變是LHON繼發突變的研究熱點,也與其他線粒體疾病如耳聾、高血壓、心血管疾病、腎病等相關[3-5]。線粒體tRNAMet 4435G>A、tRNAAla 5587T>C、tRNAThr 15927G>A以及15951A>G均被證實是LHON相關的tRNA突變[6-7]。Ji等[8]對811例LHON患者的線粒體tRNA突變位點進行篩查,發現了32個LHON相關的變異位點可能參與到LHON的發病分子機制中,如位于受體臂的突變tRNAPhe 644A>G(U70)、tRNALys 8297C > T(C3)、tRNAGly 10055A>G(U70)、tRNAHis 12141A>G(A4)、tRNAThr 15949G>A(G59)等;或位于tRNA反密碼子臂的突變tRNATrp 5539A>G(A29)、tRNACys 5802T>C(U30)和tRNASer(AGY)12223A>G(A31)[8]。線粒體tRNA變異位點可能會影響tRNA的二級結構和功能,導致線粒體tRNA代謝異常,進而影響線粒體編碼蛋白的合成,從而加劇由原發突變位點引起的線粒體功能障礙,增加LHON的外顯率。
此外,編碼線粒體復合體Ⅰ的蛋白亞基如ND1、ND4、ND6也存在著大量與LHON相關的繼發突變位點,如ND1 m.3394T>C、m.3497C>T、m.3571C>T,ND4 m.11696G>A、ND5 m.12338T>C和ND6 m.14502T>C突變,可增加由m.11778G>A突變所致的LHON的臨床表型[9-13]。利用胞質雜合細胞模型研究發現,繼發位點協同原發突變影響線粒體復合體Ⅰ的組裝和結構的穩定性,降低酶活力,從而增加攜帶原發突變m.11778G>A的患病風險[6]。
1.2 線粒體單倍體型
有研究認為,線粒體單倍體型與LHON存在一定的相關性[14-16]。單倍體型代表人類mtDNA進化樹的分支,而這些分支可以由mtDNA的多態性位點進行描述。多個相互獨立的隊列研究發現,在歐洲LHON患者中,線粒體單倍體型J與m.11778G>A及m.14484T>C存在一定的相關性,其中線粒體單倍體型J2和J1分別增加了攜帶m.11778G>A和m.14484T>C人群的LHON發病風險[14-16]。線粒體單倍體型K增加攜帶m.3460G>A人群的LHON患病風險[14]。而單倍體型H被認為可降低攜帶m.11778G>A突變的人群患LHON的風險[14]。
在東亞LHON人群研究中,并沒有發現單倍體型J與LHON的相關性,中國人群中,單倍體型M7b似乎能增加攜帶m.11778G>A突變家系成員的外顯率,而單倍體型M8a和F則降低LHON的外顯率[17-18]。另有研究表明,單倍體型M9、M10和N9可增加中國人群中攜帶m.14484T>C突變LHON家系的外顯率及表現度[19]。
線粒體單倍體型增加LHON的發病風險,可能與單倍體型上的特征性變異相關。例如,有功能研究顯示,J1和J2這兩個單倍體亞型中的4216T>C變異會降低煙酰胺腺嘌呤二核苷酸脫氫酶的活力,并可能影響線粒體復合體Ⅰ的結構穩定性[20]。M7b上的特征變異位點m.12811T>C在多篇文獻中被報道為繼發突變位點[21-22]。這說明這些單倍體型上的特征性變異位點可導致溫和的線粒體功能障礙,并協同原發突變位點達到線粒體損傷閾值,增加LHON的外顯率及表現度。
2 核修飾基因
LHON的不完全外顯和男性多發的特征,提示核基因對LHON發病有重要的調控功能。1992年,Bu和Rotter[23]對LHON的家系數據進行了“雙基因假說”的分析,發現X染色體連鎖的相關基因在LHON中具有較高的關聯性。2010年,一項對泰國LHON家系的全基因組連鎖分析研究結果顯示,LHON不僅僅與X染色體存在著中等程度的關聯,也與1、3、12、13、18號常染色體存在著中等程度的聯系[24]。與LHON相關的核修飾基因鮮有報道,目前僅報道了2個與LHON相關的核修飾基因YARS2及PRICKLE3,并對LHON的致病機制進行了深入的探索。
2.1 YARS2
YARS2基因編碼線粒體酪氨酰-tRNA合成酶,催化線粒體中的酪氨酸與tRNATyr通過酯化反應形成Tyr-tRNATyr,參與線粒體編碼蛋白的翻譯過程。Jiang等[25]在攜帶m.11778G>A的LHON家系中發現并鑒定了YARS2(c.572G>T,p.191Gly>Val)為LHON相關的核修飾基因。YARS2 c.572G>T突變造成tRNATyr氨酰化效率和tRNATyr穩態水平降低,導致線粒體編碼蛋白的翻譯水平出現障礙,從而加劇線粒體功能障礙,如復合體Ⅰ及復合體Ⅳ酶活力降低、三磷酸腺苷(ATP)合成減少、活性氧(ROS)產量增加,從而增加LHON的外顯率[25]。隨后,Jin等[26]在攜帶m.3635G>A的LHON家系中也篩查到該突變位點,并在攜帶m.3635G>A和YARS2 c.572G>T的LHON患者來源的永生化淋巴細胞系模型中進行功能驗證,結果進一步證實了YARS2是LHON相關的核修飾基因。YARS2除具有酪氨酰-tRNA合成酶的功能外,還參與線粒體復合體Ⅰ及復合體Ⅳ的組裝[27]。
2.2 PRICKLE3
PRICKLE3是平板細胞極性核心組分PRICKLE家族中的一員[28-29]。Yu等[30]在一個攜帶m.11778G>A突變的LHON家系中首次發現并鑒定了LHON相關的X-連鎖核修飾基因PRICKLE3(c.157C>T, p.Arg53Trp)。該基因位于Xp11.23,位于預測的LHON相關修飾基因的熱點區段,PRICKLE3的發現可以解釋部分LHON家系中男性高發的特點。研究發現,PRICKLE3與ATP合酶上的ATP6存在相互作用,參與線粒體ATP合酶的組裝[30]。PRICKLE3表達降低會導致完整組裝的ATP合酶減少,復合體Ⅴ酶活力降低,從而影響ATP的產生。這一現象在攜帶PRICKLE3 c.157C>T突變的LHON患者來源的淋巴細胞中得到了證實。因此,PRICKLE3c.157C>T突變協同m.11778G>A,加劇線粒體氧化磷酸化的功能障礙,導致ATP合成減少[30]。
LHON的發病具有組織特異性,RGC及其軸突特異性減少是LHON的主要特征[2]。最近,Nie等[31]利用多能誘導干細胞(iPSC)技術,將患者來源的成纖維細胞誘導為iPSC并定向分化RGC。結果顯示,攜帶PRICKLE3 c.157C>T及m.11778G>A雙突變的類RGC細胞會導致更為嚴重的線粒體功能障礙:如ATP產量顯著降低、RGC形態及電生理較對照組顯著變化、RGC凋亡比例顯著高于對照組等,說明PRICKLE3基因突變在RGC中導致能量代謝的紊亂并會增加RGC的凋亡[31]。
3 其他因素
3.1 雌激素
男性與女性間荷爾蒙的差異也被認為可能是LHON男性發病率較高的原因。女性中,雌激素被認為能夠改善線粒體的功能障礙。在攜帶LHON原發突變位點的細胞系中,加入17β-雌二醇可激活線粒體的生物發生、增強超氧化物歧化酶2的活性并降低ROS產生,減少細胞凋亡[32]。雌激素β受體在RGC的軸突中表達尤為豐富[32]。Pisano等[33]研究發現,雌激素β受體定位于線粒體上,在攜帶m.11778G>A的胞質雜合細胞模型中,加入雌激素β受體特異性結合的天然雌激素可減少細胞凋亡、誘導線粒體生物發生和降低LHON細胞中ROS產量,從而提高細胞的存活力。這些數據都顯示了雌激素在LHON的發病過程中具有一定的保護作用。
3.2 維生素B12
維生素B12對DNA合成非常重要,是兩個重要酶反應的輔因子:一個是位于線粒體上的甲基丙二酰輔酶a變位酶,可催化甲基丙二酰輔酶a轉化為琥珀酰輔酶a[34];另一個是位于細胞質的甲硫氨酸合成酶,依賴于5-甲基鈷胺和5-甲基四氫葉酸,催化同型半胱氨酸轉化為甲硫氨酸[35]。有研究認為,維生素B12缺乏會影響線粒體功能和氧化代謝,引起視神經營養不足,導致視力損傷[36]。因此,缺乏維生素B12引起的視神經病變與LHON具有相同的病理生理特征和相似的臨床表現。Zibold等[37]對攜帶LHON原發突變位點的244例患者進行維生素B12缺乏的相關研究,結果顯示,在所有年齡組中,LHON突變攜帶者的維生素B12缺乏癥患病率高于普通人群。雖然維生素B12缺乏在LHON患者和無癥狀突變攜帶者之間的患病率沒有統計學差異,但其臨床相關因素(如多神經病變)在LHON患者組中更為常見。
3.3 環境因素
吸煙和酗酒是導致LHON發病的兩個重要環境因素因素。125個歐洲LHON家系的回顧性研究顯示,吸煙與視力損傷存在著密切的聯系,相較于吸煙不多的LHON家系成員,吸煙頻次更高的成員發病比例更高[38]。研究結果顯示,該人群中男性吸煙者的外顯率為93%,而非吸煙者的外顯率為66%[38]。吸煙會減少mtDNA拷貝數、降低線粒體復合體Ⅰ酶活性和細胞色素c活力,增加ROS的產生[38]。巴西-意大利的39個LHON家系成員與吸煙相關性的研究中也發現吸煙會減少線粒體的拷貝數[39]。將患者、無癥狀攜帶者以及對照個體的白細胞或纖維母細胞暴露于香煙煙霧濃縮器中發現,所有的細胞都表現出mtDNA拷貝數降低,而ATP水平的降低僅在攜帶原發突變位點細胞中出現(包括攜帶者)。無癥狀的攜帶者中存在一個補償機制,可以增加mtDNA拷貝數,清除更多的ROS,而吸煙者由于煙霧中的毒性,降低了這一補償機制,加劇線粒體功能障礙,導致視力受損[40]。
重度酗酒也被認為與LHON的發病存在一定的聯系,但其影響不如吸煙對LHON產生的影響顯著[41]。
其他的環境因素的影響,包括頭部創傷、食物中有害毒物的攝取、工業毒害、線粒體毒性藥物的使用,如抗逆轉錄病毒藥物以及乙胺丁醇也會增加LHON的外顯率和表現度[42-45]。
4 展望
mtDNA繼發突變、線粒體單倍體型、核修飾基因、雌激素、維生素B12和環境因素是LHON的風險因素(圖1)。目前LHON的臨床研究主要局限于線粒體原發突變位點,且致病機理的研究模型僅為永生化淋巴細胞系和轉線粒體細胞系,缺乏組織特異性的細胞模型和mtDNA突變的動物模型。隨著基因測序技術的發展,新的繼發突變位點和核修飾基因正不斷被發現,LHON的各種風險因素也獲得越來越多的關注。隨著iPSC技術、CRISPR/Cas9和Mito-TALEN等基因編輯技術的發展,把患者來源的細胞重編程為視網膜神經節細胞模型,以及構建mtDNA突變的動物模型,將為線粒體原發突變位點和各種風險因素的致病機理的深入研究提供強有力的技術支撐。相信依靠大數據的深入挖掘和科研成果的不斷積累,會建立起更全面的原發突變位點和多種風險因素相結合的多維度精準化預防診療體系,實現LHON疾病的個體化預防和精準診治。
 圖1
LHON的分子致病機理 LHON:Leber遺傳性視神經病變;ATP:三磷酸腺苷;ROS:活性氧;NADH:煙酰胺腺嘌呤二核苷酸還原態;NAD+:煙酰胺腺嘌呤二核苷酸氧化態;ADP:二磷酸腺苷;CoQ:輔酶Q;CytC:細胞色素C。線粒體原發位點突變m.11778G>A、m.14484T>C和m.3460G>A是LHON發病的分子基礎,諸多風險因素如線粒體繼發突變位點、線粒體單倍體型、核修飾基因及其他因素主要加劇線粒體呼吸鏈功能障礙,導致線粒體ATP合成減少、ROS生成增多,最終誘發細胞凋亡
圖1
LHON的分子致病機理 LHON:Leber遺傳性視神經病變;ATP:三磷酸腺苷;ROS:活性氧;NADH:煙酰胺腺嘌呤二核苷酸還原態;NAD+:煙酰胺腺嘌呤二核苷酸氧化態;ADP:二磷酸腺苷;CoQ:輔酶Q;CytC:細胞色素C。線粒體原發位點突變m.11778G>A、m.14484T>C和m.3460G>A是LHON發病的分子基礎,諸多風險因素如線粒體繼發突變位點、線粒體單倍體型、核修飾基因及其他因素主要加劇線粒體呼吸鏈功能障礙,導致線粒體ATP合成減少、ROS生成增多,最終誘發細胞凋亡