引用本文: 陳波, 唐康來, 張吉強, 郭宇鵬, 劉翔周, 施又興. 抑制肌動蛋白聚合對體外大鼠跟腱來源肌腱干細胞成脂分化的影響研究. 中國修復重建外科雜志, 2015, 29(2): 206-212. doi: 10.7507/1002-1892.20150045 復制
肌腱病是目前最常見的運動損傷性疾病,主要臨床表現為疼痛和炎性反應,晚期病變嚴重時可在病變肌腱內發現異位骨化和脂肪化組織形成[1]。由于肌腱自身再生能力較差,通過傳統治療再生的肌腱主要是由瘢痕組織構成,很難達到結構的完整性及滿足生理活動所需強度[2]。隨著研究者們從人和動物的肌腱組織中成功分離提取出肌腱干細胞(tendon stem cells,TSCs),并發現TSCs是肌腱組織工程良好的種子細胞之后[3-6],TSCs特性逐漸成為當前研究熱點。
近年來,有研究表明在過度牽伸載荷條件下TSCs會出現異常分化(成脂、成骨分化),加速肌腱病的發展,最終導致脂質蓄積、鈣化形成等晚期肌腱病的主要病理表現[7-8],但其發生機制尚不明確。我們前期實驗發現,不同牽伸載荷可導致體外培養的肌腱來源細胞的聚合態纖維肌動蛋白(fibros actin,F-actin)發生斷裂、解聚、重組,最終誘導肌腱來源細胞發生牽伸時間、強度和頻率依賴性形態改變[9]。機械牽伸載荷是否通過影響細胞骨架和細胞形態改變,進而影響TSCs的分化方向,目前缺少相關研究報道。為此,本實驗采用細胞松弛素D(cytochalasin D,CYD)抑制大鼠跟腱源性TSCs可溶球狀肌動蛋白(globular actin,G-actin)聚合成F-actin,探討細胞骨架對TSCs成脂分化的影響,以期為肌腱病發病機制研究及治療提供新思路。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
3周齡SD雄性大鼠2只,體重約50 g,由第三軍醫大學實驗動物中心提供。H-DMEM培養基、胰蛋白酶(HyClone 公司,美國);FBS(GIBCO公司,美國);I型膠原酶、中性蛋白酶、CYD (Sigma公司,美國);SD大鼠BMSCs成脂分化完全培養基(廣州賽業生物科技有限公司);羅丹明標記的鬼筆環肽(Biotium公司,美國);RNAiso Plus試劑盒(TaKaRa公司,日本);總蛋白提取試劑盒(上海貝博生物公司);BCA蛋白濃度測定試劑盒(北京康為世紀生物科技有限公司);抗actin抗體、抗脂肪酸結合蛋白(aP2)抗體、抗過氧化物酶體增殖物激活受體γ (per oxi some proliferator-activated receptor γ,PPARγ)抗體(Abcam公司,美國)。Quantity One軟件(Bio-Rad公司,美國);倒置相差顯微鏡(Olympus公司,日本);LSM510META型激光共聚焦顯微鏡(Zeiss公司,德國)。
1.2 TSCs分離、培養及鑒定
參照文獻 [6, 10]方法進行TSCs的分離、培養和鑒定。無菌條件下取2只大鼠雙側跟腱,剔除腱鞘及腱周結締組織,PBS清洗3次;將肌腱剪碎成1 mm×1 mm×1 mm大小,加入2 mL消化液(含3 mg/ mLⅠ 型膠原酶和4 mg/mL中性蛋白酶),37℃孵箱消化1.5 h;加入含15%FBS的DMEM培養基2 mL中止消化,以離心半徑10 cm、1 000 r/min離心5 min,棄上清。加入含15%FBS的DMEM培養基4 mL重懸細胞,移入25 cm2培養瓶中,置于37℃、5%CO2細胞培養箱中孵育,每3天換液1次。細胞擴增傳代,原代細胞記為P0代,取P3代細胞用于實驗。經檢測干細胞表面標志物CD90、CD44、Oct-4和誘導成骨、成軟骨、成脂肪分化,鑒定培養細胞為TSCs。
1.3 CYD濃度篩選實驗
取P3代TSCs,以1.5×103個/孔密度接種于24孔培養板,待細胞貼壁生長后,參考文獻[11]方法分為5組,分別換用CYD終濃度為0(對照組)、50、100、500、1 000 ng/mL的含15%FBS的DMEM培養基500 μL繼續培養,每3天換液1次。干預后1 h及3、7 d,倒置相差顯微鏡下觀察細胞存活及形態變化,選擇不影響TSCs存活的最大CYD濃度作為實驗濃度,并進一步觀察明確。
① F-actin染色:取選擇的實驗濃度組及對照組培養1 h及3、7 d的細胞制作細胞爬片,行F-actin染色,觀察該濃度CYD對細胞骨架的影響效果。預冷PBS漂洗細胞爬片2次,4%多聚甲醛室溫固定30 min;PBS漂洗3次,0.5%Triton X-100室溫下處理細胞30 min;PBS漂洗2次,3%脫脂奶粉4℃冰箱封閉1 h;PBS漂洗2次,羅丹明標記的鬼筆環肽染色液室溫避光孵育30 min;PBS快速漂洗2次,DAPI室溫染核5 min;PBS快速漂洗3次,滴加抗熒光淬滅封片液封片,采用激光共聚焦顯微鏡觀察細胞骨架F-actin。② Wesrtern blot檢測:參照文獻[12]方法通過Western blot檢測并計算F-actin/G-actin比值。取選擇的實驗濃度組培養3、7 d及對照組培養7 d的細胞,用冷裂解液1 (含10 mmol/L K2HPO4、100 mmol/L NaF、50 mmol/L KCl、2 mmol/ L MgCl2、1 mmol/L乙二醇雙氨乙基醚四乙酸、0.2 mmol/L二硫蘇糖醇、0.5%Triton X-100、1 mmol/L蔗糖,pH7.0)裂解,以離心半徑8 cm、16 000 r/min離心30 min,G-actin在上清液中。沉淀的F-actin重新用等體積裂解液2(1.5 mmol/L鹽酸胍、1 mmol/L乙酸鈉,1 mmol/L CaCl2、1 mmol/L三磷酸腺苷、20 mmol/L Tris-HCl,pH7.5)冰浴1 h,將其轉化為可溶的G-actin(每隔15 min溫和震蕩);然后以離心半徑8 cm、16 000 r/min離心30 min,已轉化為G-actin的F-actin在上清液中。將兩次裂解離心得到的上清液取等量上樣,使用抗actin抗體檢測,最后將條帶灰度值用于比值計算。
1.4 CYD對TSCs成脂分化的影響
1.4.1 成脂誘導培養基培養
取P3代TSCs,以3×105個/孔密度接種于6孔培養板,依據篩選的CYD最適濃度,分別采用成脂誘導培養基(誘導組)、含CYD的成脂誘導培養基(CYD+誘導組)于37℃、5%CO2孵箱中培養細胞,每3天換液1次。培養3、7 d收集細胞,進行實時熒光定量PCR及Western blot檢測。
1.4.2 普通培養基培養
取P3代TSCs,以1.5×105 個/孔密度接種于6孔培養板,依據篩選的CYD最適濃度,分別采用普通培養基(普通組)、含 CYD的普通培養基(CYD+普通組)培養。同上法培養3、7 d收集細胞,進行實時熒光定量PCR檢 測。
1.4.3 觀測指標
① 實時熒光定量PCR檢測成脂分化相關特異標志性基因表達:使用RNAiso Plus試劑盒提取細胞總RNA,并轉錄為cDNA。各目的基因引物序列:PPARγ上游5'-CCTTTACCACGGTT-
GATTTCTC-3',下游5'-GGCTCTACTTTGATCGCA-
CTTT-3';脂蛋白酯酶(1ipoprotein lipase,LPL)上游
5'-CCCAGCAACATTATCCAGTG-3',下游5'-CCTA-
AGAGGTGGACATTGTC-3';aP2上游5'-CGAGAT-
TTCCTTCAAACTGGG-3',下游5'-TCTTGTAGAA-
GTCACGCCTTTC-3'; GAPDH上游5'-TGACTTC-
AACAGCAACTC-3',下游5'-TGTAGCCATATTCA-
TTGTCA-3'。循環條件:95℃預變性8 min;95℃變性10 s、60℃退火20 s、72℃延伸25 s,40個循環。溶解曲線分析為:55~95℃,0.5℃/15 s。采用2-ΔΔCt法分析目的基因相對表達量,以GAPDH作為內參。實驗重復3次。② Western blot檢測:使用總蛋白提取試劑盒提取細胞總蛋白,BCA蛋白濃度測定試劑盒測定蛋白濃度,10%SDS-PAGE凝膠電泳,聚偏氟乙烯膜轉膜,5%脫脂奶粉封閉,稀釋一抗(抗actin抗體、抗aP2抗體、抗PPARγ抗體)4℃孵育過夜;二抗室溫孵育2 h,洗膜,用ECL試劑盒顯影。應用Quantity One軟件分析蛋白表達水平。實驗重復3 次。
1.5 統計學方法
采用SPSS13.0統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用t檢驗;檢驗水準α=0.05。
2 結果
2.1 CYD對TSCs的適用濃度篩選
2.1.1 細胞形態觀察
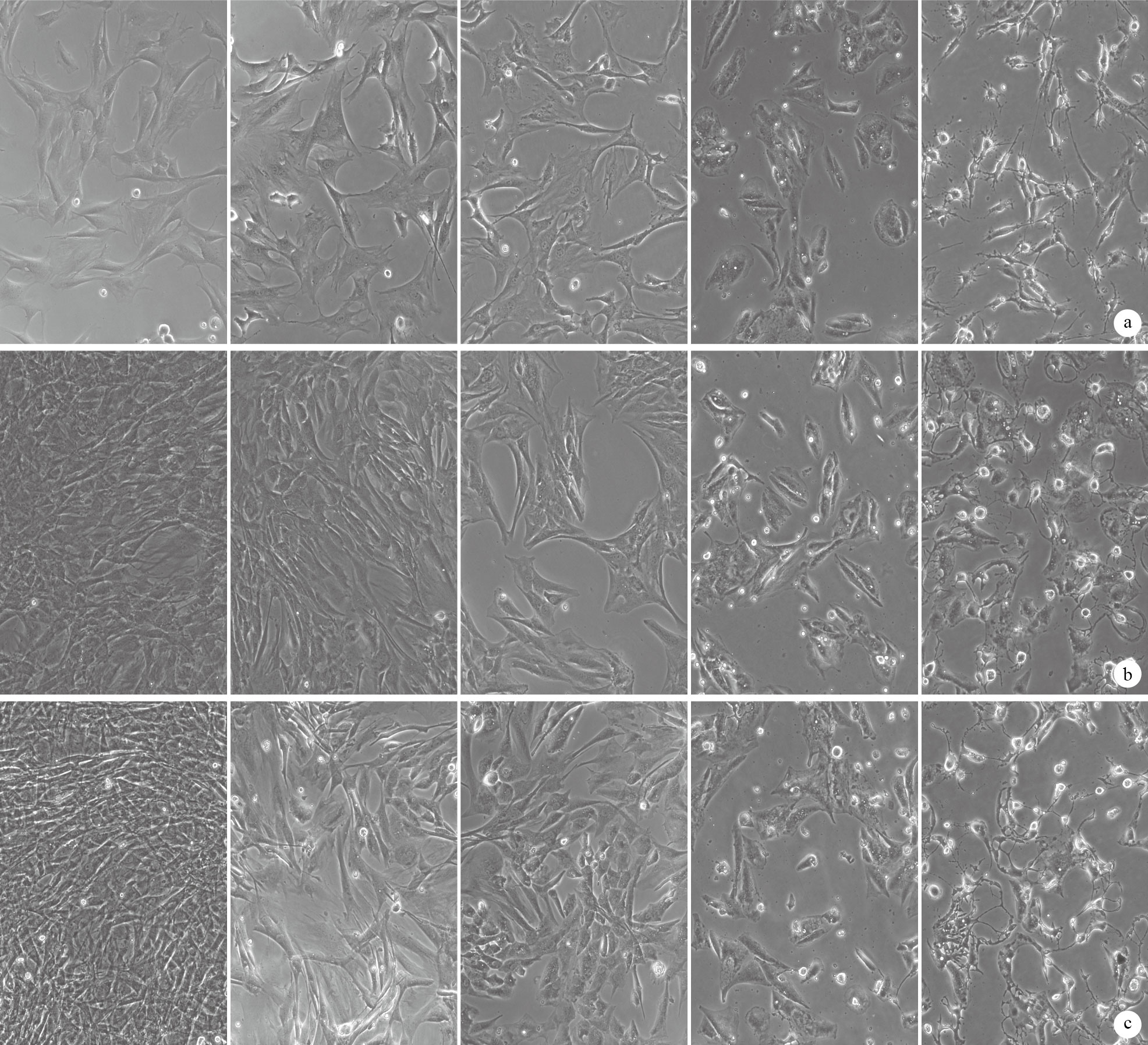
倒置相差顯微鏡觀察示,與對照組比較,CYD各濃度組TSCs伸展度減小,形態逐漸變圓。CYD終濃度為50、100 ng/mL時,各時間點TSCs存活未受明顯影響;終濃度為500、1 000 ng/ mL時,可見呈核固縮狀態的死亡TSCs,且死亡細胞數量隨著CYD終濃度、干預時間的增加而增加。見圖 1。鑒于此,初步選擇CYD終濃度為100 ng/mL進行后續實驗。
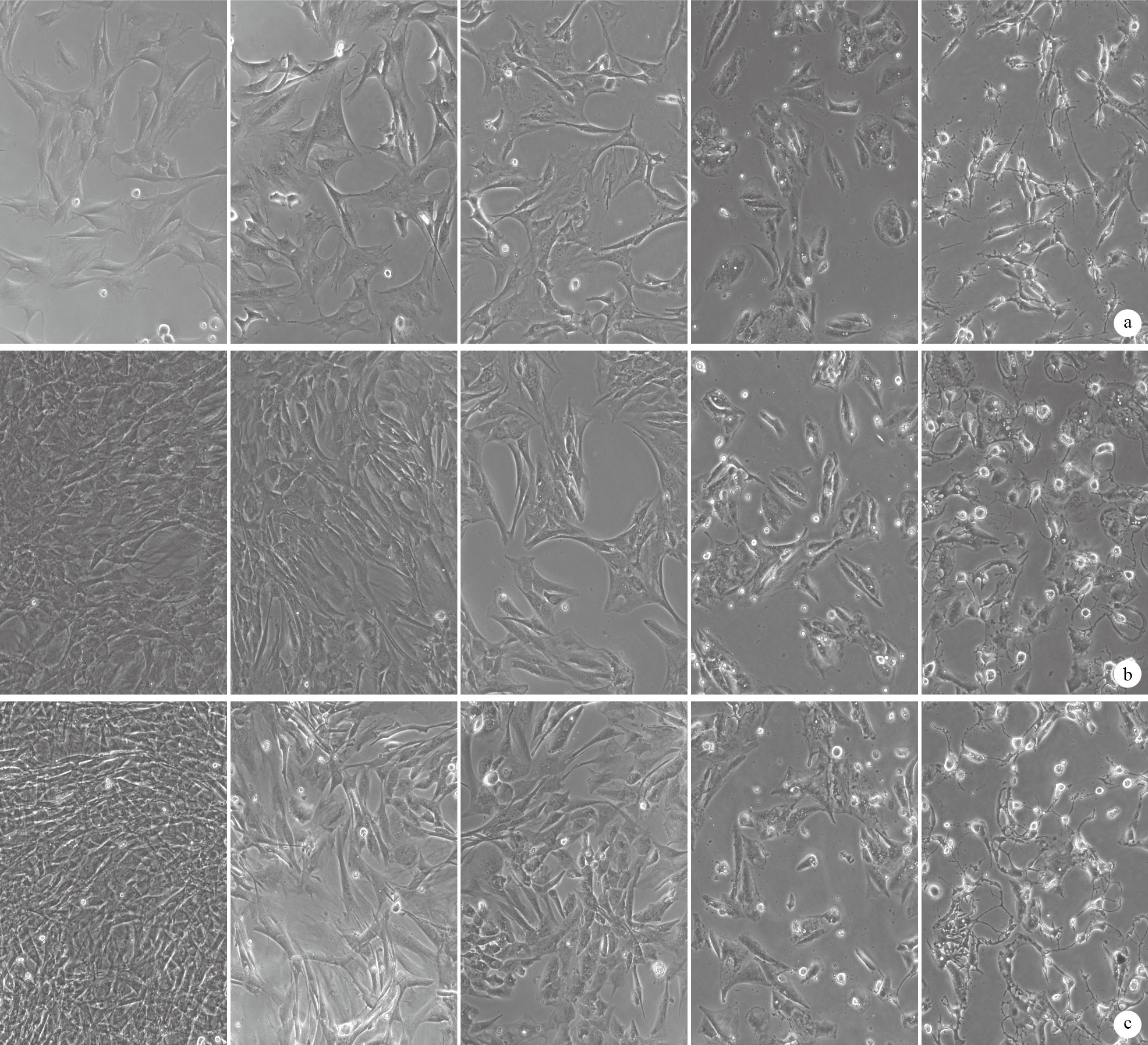 圖1
各組細胞存活狀態及形態觀察(倒置相差顯微鏡×100) 從左至右分別為對照組、50 ng/mL組、100 ng/mL組、500 ng/mL組、1 000 ng/mL組 ? 培養1 h ? 培養3 d ? 培養7 d
Figure1.
The survival condition and morphology observation of cells in each group (Inverted phase contrast microscope×100) They were the control group,50 ng/mL group,100 ng/mL group,500 ng/mL group,and 1 000 ng/mL group from left to right respectively ? Cultured for 1 hour ? Cultured for 3 days ? Cultured for 7 days
圖1
各組細胞存活狀態及形態觀察(倒置相差顯微鏡×100) 從左至右分別為對照組、50 ng/mL組、100 ng/mL組、500 ng/mL組、1 000 ng/mL組 ? 培養1 h ? 培養3 d ? 培養7 d
Figure1.
The survival condition and morphology observation of cells in each group (Inverted phase contrast microscope×100) They were the control group,50 ng/mL group,100 ng/mL group,500 ng/mL group,and 1 000 ng/mL group from left to right respectively ? Cultured for 1 hour ? Cultured for 3 days ? Cultured for 7 days
2.1.2 F-actin染色
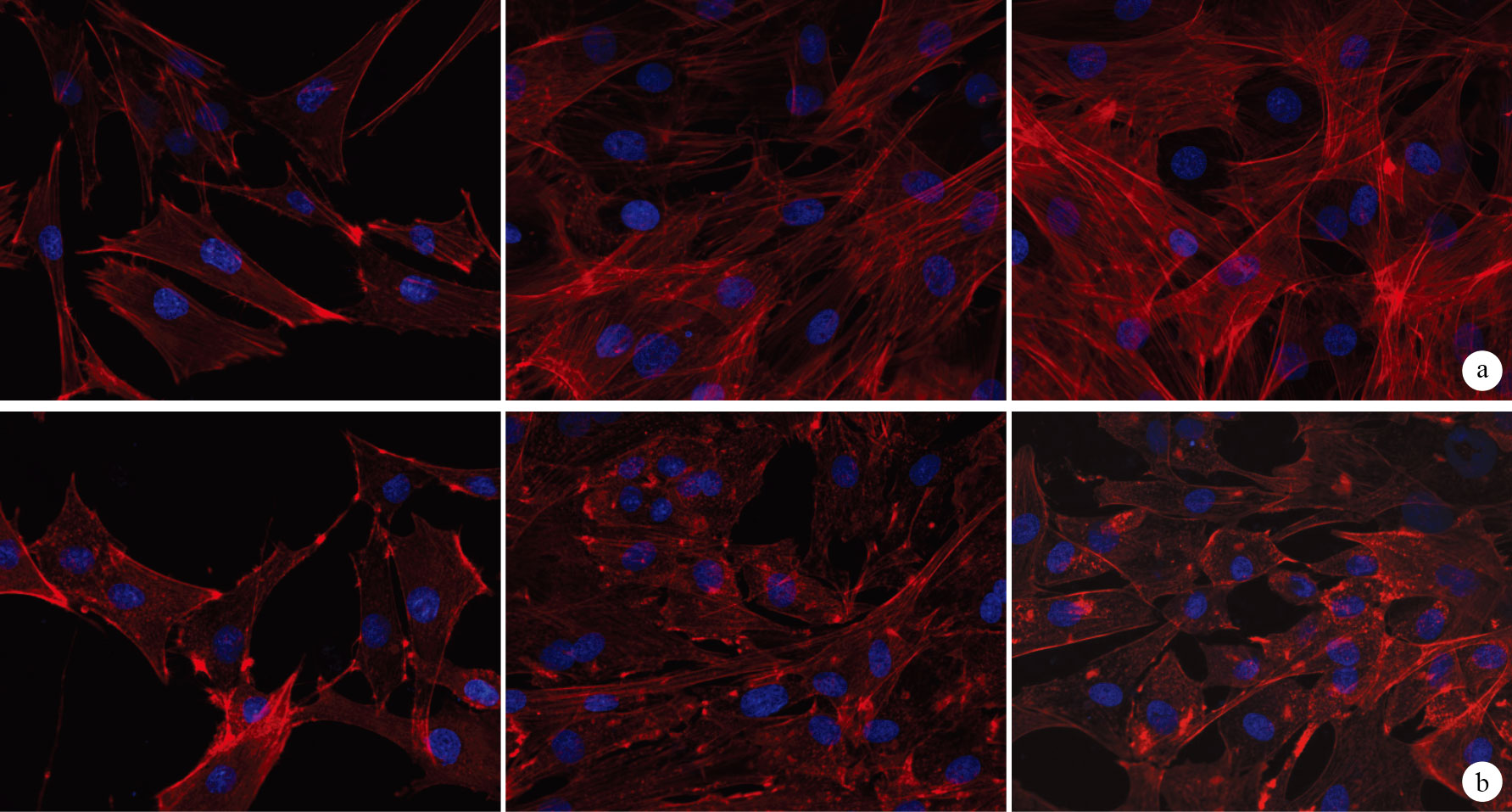
激光共聚焦顯微鏡觀察示,對照組TSCs較伸展,呈不規則多角形,熒光強,細胞骨架F-actin呈彌漫狀橘紅色熒光樣物質,分布清晰,細胞質內肌動蛋白纖維絲方向相對規則。而100 ng/ mL組TSCs在干預1 h后即出現胞體伸展度減小,形態相對圓滑,細胞骨架F-actin排列紊亂、模糊、減少,呈顆粒狀斷裂;隨著時間延長,F-actin受到的影響呈遞增趨勢。見圖 2。
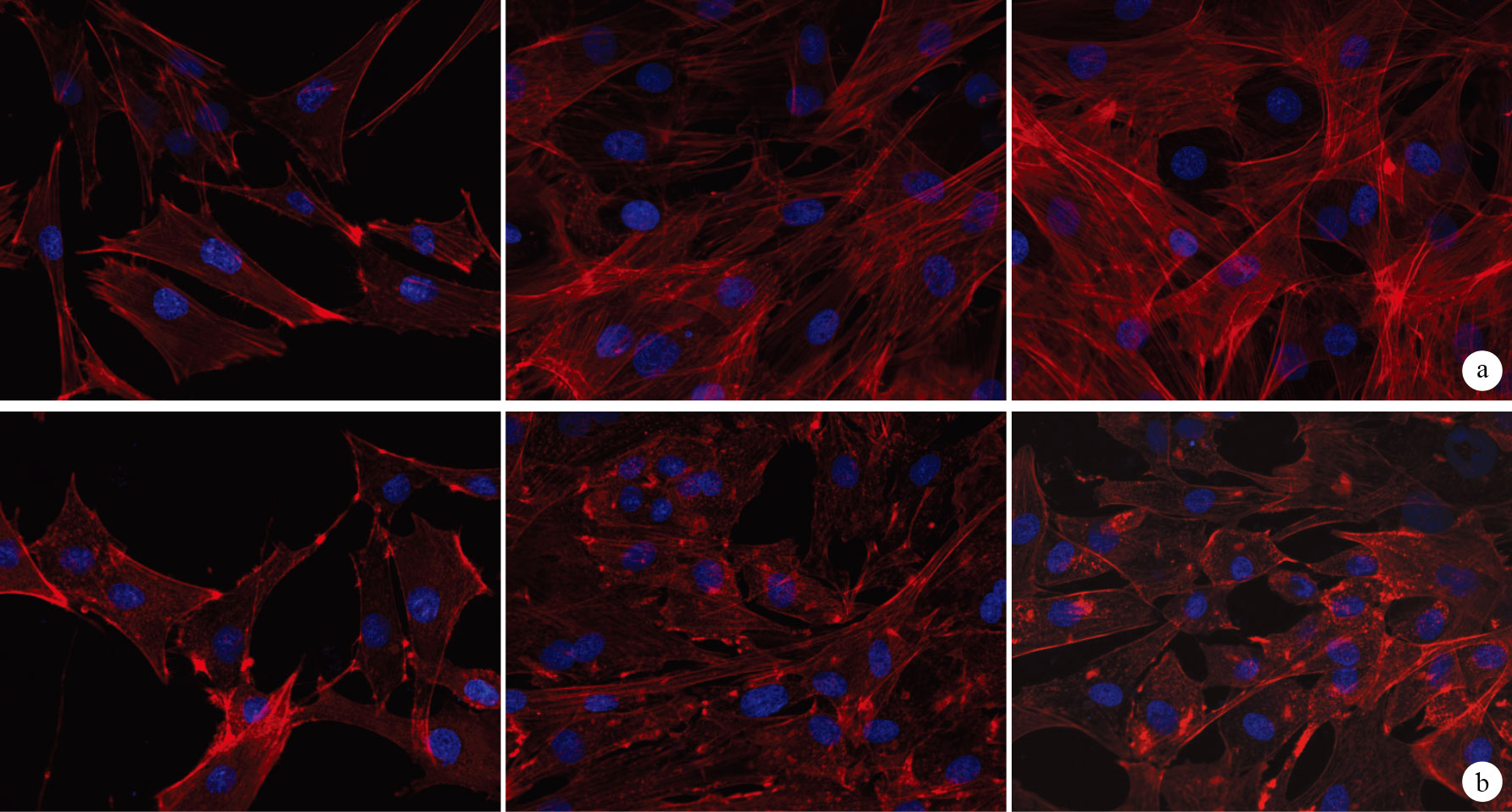 圖2
100 ng/mL組及對照組F-actin染色觀察(激光共聚焦顯微鏡×400) 從左至右分別為干預1 h、3 d、7 d ? 對照組 ? 100 ng/mL組
Figure2.
The F-actin staining observation of 100 ng/mL group and control group (Confocal laser scanning microscope×400) The intervention time was 1 hour,3 days,and 7 days from left to right respectively ? Control group ? 100 ng/mL group
圖2
100 ng/mL組及對照組F-actin染色觀察(激光共聚焦顯微鏡×400) 從左至右分別為干預1 h、3 d、7 d ? 對照組 ? 100 ng/mL組
Figure2.
The F-actin staining observation of 100 ng/mL group and control group (Confocal laser scanning microscope×400) The intervention time was 1 hour,3 days,and 7 days from left to right respectively ? Control group ? 100 ng/mL group
2.1.3 Wesrtern
blot檢測 對照組F-actin/G-actin比值為0.738±0.076,顯著高于100 ng/mL組3、7 d的0.399±0.069、0.361±0.061,比較差異均有統計學意義(t=38.333,P=0.001;t=31.405,P=0.001)。100 ng/mL組3、7 d間F-actin/G-actin比值比較,差異亦有統計學意義(t=8.130,P=0.015)。
根據上述實驗結果,提示CYD終濃度為100 ng/ mL時既可有效干擾TSCs細胞骨架F-actin的聚合,又不影響TSCs的存活,確定以該濃度用于進一步研究。
2.2 CYD對TSCs成脂分化的影響
2.2.1 成脂誘導培養基培養
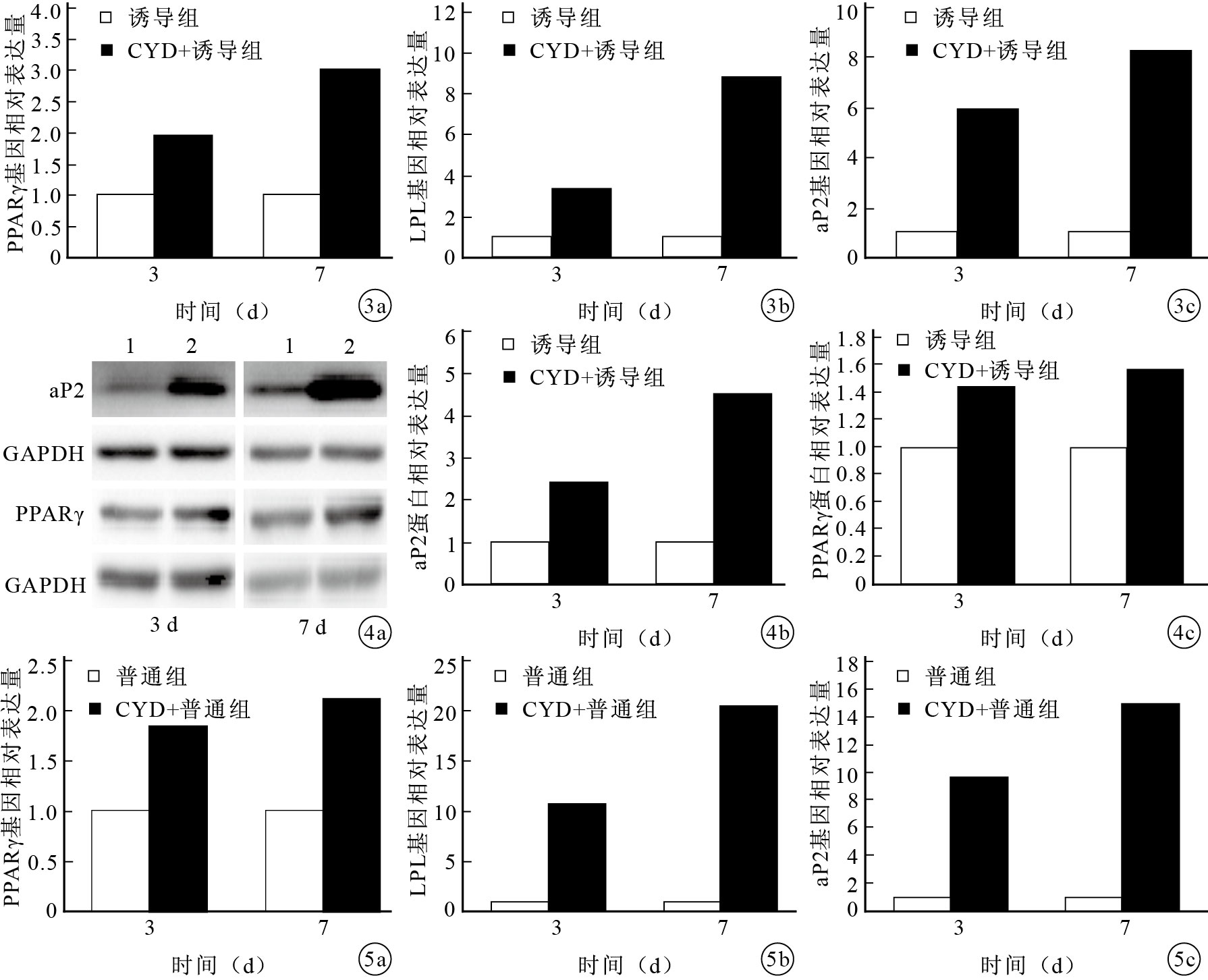
實時熒光定量PCR檢測示,3、7 d時CYD+誘導組PPARγ、LPL和aP2基因相對表達量顯著高于誘導組,比較差異有統計學意義(P<0.05)。各基因相對表達量隨CYD干預時間延長呈遞增趨勢,比較差異有統計學意義(P<0.05)。見圖 3。
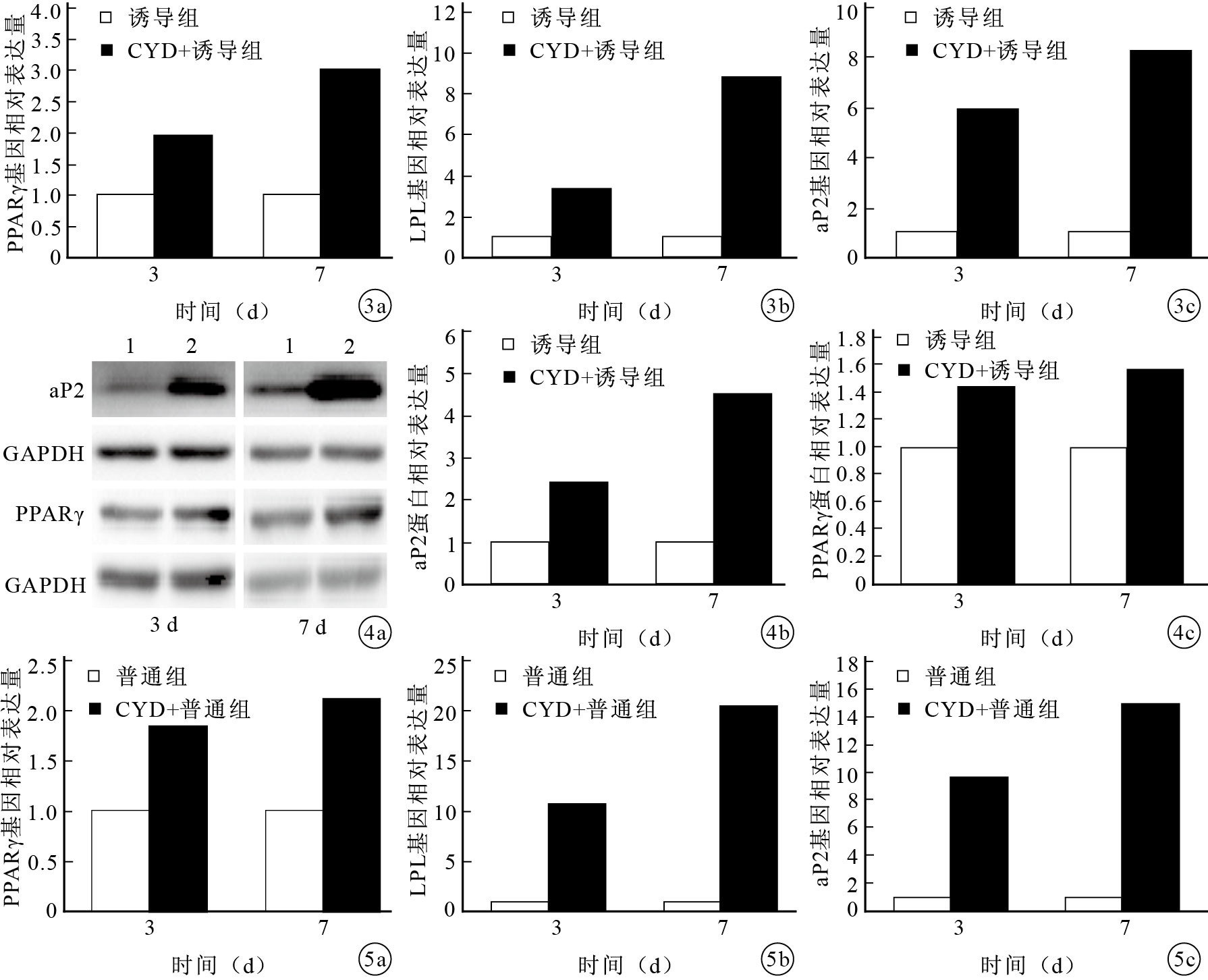 圖3
實時熒光定量PCR檢測CYD+誘導組和誘導組PPARγ、LPL、aP2基因表達 ? PPARγ ? LPL ? aP2? ?圖 4 Western blot檢測CYD+誘導組和誘導組PPARγ、aP2蛋白表達 ? 電泳圖 1:誘導組 2:CYD+誘導組 ? aP2蛋白表達水平 PPARγ蛋白表達水平? ?圖 5 實時定量PCR檢測CYD+普通組和普通組PPARγ、LPL、aP2基因表達 ? PPARγ ? LPL ? aP2
Figure3.
The mRNA expressions of PPARγ,LPL,and aP2 in CYD+induction group and induction group by real-time quantitative PCR ? PPARγ ? LPL ? aP2? ? Fig. 4 The protein expressions of PPARγ and aP2 in CYD+induction group and induction group by Western blot ? Electrophoretogram 1: Induction group 2: CYD+induction group Protein expression of PPARγ ? Protein expression of aP2? ? Fig. 5 The mRNA expressions of PPARγ,LPL,and aP2 in CYD+ordinary group and ordinary group by real-time quantitative PCR ? PPARγ ? LPL ? aP2
圖3
實時熒光定量PCR檢測CYD+誘導組和誘導組PPARγ、LPL、aP2基因表達 ? PPARγ ? LPL ? aP2? ?圖 4 Western blot檢測CYD+誘導組和誘導組PPARγ、aP2蛋白表達 ? 電泳圖 1:誘導組 2:CYD+誘導組 ? aP2蛋白表達水平 PPARγ蛋白表達水平? ?圖 5 實時定量PCR檢測CYD+普通組和普通組PPARγ、LPL、aP2基因表達 ? PPARγ ? LPL ? aP2
Figure3.
The mRNA expressions of PPARγ,LPL,and aP2 in CYD+induction group and induction group by real-time quantitative PCR ? PPARγ ? LPL ? aP2? ? Fig. 4 The protein expressions of PPARγ and aP2 in CYD+induction group and induction group by Western blot ? Electrophoretogram 1: Induction group 2: CYD+induction group Protein expression of PPARγ ? Protein expression of aP2? ? Fig. 5 The mRNA expressions of PPARγ,LPL,and aP2 in CYD+ordinary group and ordinary group by real-time quantitative PCR ? PPARγ ? LPL ? aP2
Western blot檢測示,3、7 d時CYD+誘導組PPARγ、aP2蛋白相對表達量顯著高于誘導組,比較差異有統計學意義(P<0.05);并且相對表達量隨CYD干預時間的延長有遞增趨勢,比較差異亦有統計學意義(P<0.05)。見圖 4。
2.2.2 普通培養基培養
實時熒光定量PCR檢測示,3、7 d時CYD+普通組PPARγ、LPL和aP2基因相對表達量顯著高于普通組,比較差異有統計學意義(P<0.05);且LPL、aP2基因的相對表達量隨CYD干預時間的延長呈遞增趨勢,比較差異有統計學意義(P<0.05);PPARγ基因相對表達量在CYD干預3 d和7 d時比較差異無統計學意義(P>0.05)。見圖 5。
3 討論
細胞骨架是維持細胞形態的關鍵結構,其動態變化在細胞黏附、遷移、凋亡、細胞周期、信號轉導等生理過程中均有著重要作用[13-15],主要由微管、微絲及中間纖維共同構成。其中,微絲是由F-actin聚合形成,與肌動蛋白結合蛋白交聯以形成網絡狀結構[16],作為一種應力纖維,在機械牽伸等力學刺激應答過程中起關鍵作用。有研究報道,在力學刺激信號由細胞外基質向細胞內轉導過程中,通過形成一個“細胞外基質-整合素-細胞骨架-細胞核”的網架系統,細胞外的機械力信號可沿此“軌道”傳導,進而使細胞對該力學刺激發生一系列后續反應[17-18]。除了感受力學刺激外,細胞骨架還能將力學信號轉換為化學信號。當肌動蛋白纖維收縮時,細胞骨架相關蛋白也會受到牽伸,此時便會出現一些新的細胞骨架相關蛋白結合位點,進而使一些信號蛋白發生磷酸化而被激活[19]。隨著對干細胞研究的深入,有學者發現細胞骨架在調控干細胞分化功能方面也起著重要作用[20]。有研究證實當聚集成團生長時,細胞多接近呈圓形,更容易向軟骨細胞分化[21];當MSCs形態被干預成圓形時,多向成脂肪分化;而當MSCs伸展開后,則更傾向于成骨分化[22]。
本研究探討了細胞骨架在TSCs成脂分化過程中的作用。首先從大鼠跟腱中分離出TSCs,并通過觀察細胞呈鵝卵石樣聚集生長,檢測干細胞表面標志物CD90、CD44、Oct-4以及成功誘導其成骨、成軟骨、成脂肪分化,證實了所培養細胞為TSCs[10]。然后通過濃度篩選實驗,在不影響TSCs存活狀態的前提下,使用CYD干預TSCs培養,結果顯示:100 ng/mL終濃度的CYD可有效干擾TSCs細胞骨架F-actin的聚合,并且隨著干預時間延長,F-actin受到的影響呈遞增趨勢。隨后在TSCs成脂誘導培養過程中,通過使用CYD干擾其細胞骨架F-actin的聚合發現:相對于單純的TSCs成脂誘導培養,CYD干預可明顯促進TSCs成脂誘導培養的誘導效率。表明細胞骨架的變化參與了TSCs成脂分化的調控,但是其在TSCs成脂分化過程中的作用究竟是協同增強成脂誘導培養基的誘導作用,還是可單獨啟動TSCs向成脂方向分化尚不清楚。為此,我們進一步在TSCs普通培養過程中使用CYD干擾其細胞骨架F-actin的聚合,發現在無誘導因素情況下,單純CYD干預也可明顯促進TSCs成脂分化。表明細胞骨架的變化是導致TSCs發生成脂分化的誘導啟動因素。上述實驗結果與CYD干預能促進MSCs成脂分化是一致的[23],并且進一步深化了我們課題組前期研究發現:8%牽伸應變量對TSCs能產生過度牽伸效果,并且可使TSCs中RhoA/Rho相關蛋白激酶(Rho as soc iat ed protein kinases,ROCK)分子表達顯著升高[24],而RhoA/ROCK分子具有機械敏感性[25],當受到外界應力時,RhoA/ROCK通過調節細胞骨架重塑,導致干細胞發生形狀變化,使干細胞向不同方向分化[22]。
綜上述,在TSCs成脂分化過程中,細胞骨架的變化起著非常重要的作用,它不是TSCs成脂分化的一個結果,而是導致TSCs成脂分化的早期細胞內改變之一。這表明機械牽伸載荷有可能是通過影響細胞骨架和細胞形態改變,進而影響TSCs的分化方向,為肌腱病發病機制研究及治療提供了新思路。但本研究目前只研究了細胞骨架對TSCs成脂分化的調控作用,對于細胞骨架在TSCs向其他方向分化時的影響以及細胞骨架上下游的調控信號分子尚需進一步研究。
肌腱病是目前最常見的運動損傷性疾病,主要臨床表現為疼痛和炎性反應,晚期病變嚴重時可在病變肌腱內發現異位骨化和脂肪化組織形成[1]。由于肌腱自身再生能力較差,通過傳統治療再生的肌腱主要是由瘢痕組織構成,很難達到結構的完整性及滿足生理活動所需強度[2]。隨著研究者們從人和動物的肌腱組織中成功分離提取出肌腱干細胞(tendon stem cells,TSCs),并發現TSCs是肌腱組織工程良好的種子細胞之后[3-6],TSCs特性逐漸成為當前研究熱點。
近年來,有研究表明在過度牽伸載荷條件下TSCs會出現異常分化(成脂、成骨分化),加速肌腱病的發展,最終導致脂質蓄積、鈣化形成等晚期肌腱病的主要病理表現[7-8],但其發生機制尚不明確。我們前期實驗發現,不同牽伸載荷可導致體外培養的肌腱來源細胞的聚合態纖維肌動蛋白(fibros actin,F-actin)發生斷裂、解聚、重組,最終誘導肌腱來源細胞發生牽伸時間、強度和頻率依賴性形態改變[9]。機械牽伸載荷是否通過影響細胞骨架和細胞形態改變,進而影響TSCs的分化方向,目前缺少相關研究報道。為此,本實驗采用細胞松弛素D(cytochalasin D,CYD)抑制大鼠跟腱源性TSCs可溶球狀肌動蛋白(globular actin,G-actin)聚合成F-actin,探討細胞骨架對TSCs成脂分化的影響,以期為肌腱病發病機制研究及治療提供新思路。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
3周齡SD雄性大鼠2只,體重約50 g,由第三軍醫大學實驗動物中心提供。H-DMEM培養基、胰蛋白酶(HyClone 公司,美國);FBS(GIBCO公司,美國);I型膠原酶、中性蛋白酶、CYD (Sigma公司,美國);SD大鼠BMSCs成脂分化完全培養基(廣州賽業生物科技有限公司);羅丹明標記的鬼筆環肽(Biotium公司,美國);RNAiso Plus試劑盒(TaKaRa公司,日本);總蛋白提取試劑盒(上海貝博生物公司);BCA蛋白濃度測定試劑盒(北京康為世紀生物科技有限公司);抗actin抗體、抗脂肪酸結合蛋白(aP2)抗體、抗過氧化物酶體增殖物激活受體γ (per oxi some proliferator-activated receptor γ,PPARγ)抗體(Abcam公司,美國)。Quantity One軟件(Bio-Rad公司,美國);倒置相差顯微鏡(Olympus公司,日本);LSM510META型激光共聚焦顯微鏡(Zeiss公司,德國)。
1.2 TSCs分離、培養及鑒定
參照文獻 [6, 10]方法進行TSCs的分離、培養和鑒定。無菌條件下取2只大鼠雙側跟腱,剔除腱鞘及腱周結締組織,PBS清洗3次;將肌腱剪碎成1 mm×1 mm×1 mm大小,加入2 mL消化液(含3 mg/ mLⅠ 型膠原酶和4 mg/mL中性蛋白酶),37℃孵箱消化1.5 h;加入含15%FBS的DMEM培養基2 mL中止消化,以離心半徑10 cm、1 000 r/min離心5 min,棄上清。加入含15%FBS的DMEM培養基4 mL重懸細胞,移入25 cm2培養瓶中,置于37℃、5%CO2細胞培養箱中孵育,每3天換液1次。細胞擴增傳代,原代細胞記為P0代,取P3代細胞用于實驗。經檢測干細胞表面標志物CD90、CD44、Oct-4和誘導成骨、成軟骨、成脂肪分化,鑒定培養細胞為TSCs。
1.3 CYD濃度篩選實驗
取P3代TSCs,以1.5×103個/孔密度接種于24孔培養板,待細胞貼壁生長后,參考文獻[11]方法分為5組,分別換用CYD終濃度為0(對照組)、50、100、500、1 000 ng/mL的含15%FBS的DMEM培養基500 μL繼續培養,每3天換液1次。干預后1 h及3、7 d,倒置相差顯微鏡下觀察細胞存活及形態變化,選擇不影響TSCs存活的最大CYD濃度作為實驗濃度,并進一步觀察明確。
① F-actin染色:取選擇的實驗濃度組及對照組培養1 h及3、7 d的細胞制作細胞爬片,行F-actin染色,觀察該濃度CYD對細胞骨架的影響效果。預冷PBS漂洗細胞爬片2次,4%多聚甲醛室溫固定30 min;PBS漂洗3次,0.5%Triton X-100室溫下處理細胞30 min;PBS漂洗2次,3%脫脂奶粉4℃冰箱封閉1 h;PBS漂洗2次,羅丹明標記的鬼筆環肽染色液室溫避光孵育30 min;PBS快速漂洗2次,DAPI室溫染核5 min;PBS快速漂洗3次,滴加抗熒光淬滅封片液封片,采用激光共聚焦顯微鏡觀察細胞骨架F-actin。② Wesrtern blot檢測:參照文獻[12]方法通過Western blot檢測并計算F-actin/G-actin比值。取選擇的實驗濃度組培養3、7 d及對照組培養7 d的細胞,用冷裂解液1 (含10 mmol/L K2HPO4、100 mmol/L NaF、50 mmol/L KCl、2 mmol/ L MgCl2、1 mmol/L乙二醇雙氨乙基醚四乙酸、0.2 mmol/L二硫蘇糖醇、0.5%Triton X-100、1 mmol/L蔗糖,pH7.0)裂解,以離心半徑8 cm、16 000 r/min離心30 min,G-actin在上清液中。沉淀的F-actin重新用等體積裂解液2(1.5 mmol/L鹽酸胍、1 mmol/L乙酸鈉,1 mmol/L CaCl2、1 mmol/L三磷酸腺苷、20 mmol/L Tris-HCl,pH7.5)冰浴1 h,將其轉化為可溶的G-actin(每隔15 min溫和震蕩);然后以離心半徑8 cm、16 000 r/min離心30 min,已轉化為G-actin的F-actin在上清液中。將兩次裂解離心得到的上清液取等量上樣,使用抗actin抗體檢測,最后將條帶灰度值用于比值計算。
1.4 CYD對TSCs成脂分化的影響
1.4.1 成脂誘導培養基培養
取P3代TSCs,以3×105個/孔密度接種于6孔培養板,依據篩選的CYD最適濃度,分別采用成脂誘導培養基(誘導組)、含CYD的成脂誘導培養基(CYD+誘導組)于37℃、5%CO2孵箱中培養細胞,每3天換液1次。培養3、7 d收集細胞,進行實時熒光定量PCR及Western blot檢測。
1.4.2 普通培養基培養
取P3代TSCs,以1.5×105 個/孔密度接種于6孔培養板,依據篩選的CYD最適濃度,分別采用普通培養基(普通組)、含 CYD的普通培養基(CYD+普通組)培養。同上法培養3、7 d收集細胞,進行實時熒光定量PCR檢 測。
1.4.3 觀測指標
① 實時熒光定量PCR檢測成脂分化相關特異標志性基因表達:使用RNAiso Plus試劑盒提取細胞總RNA,并轉錄為cDNA。各目的基因引物序列:PPARγ上游5'-CCTTTACCACGGTT-
GATTTCTC-3',下游5'-GGCTCTACTTTGATCGCA-
CTTT-3';脂蛋白酯酶(1ipoprotein lipase,LPL)上游
5'-CCCAGCAACATTATCCAGTG-3',下游5'-CCTA-
AGAGGTGGACATTGTC-3';aP2上游5'-CGAGAT-
TTCCTTCAAACTGGG-3',下游5'-TCTTGTAGAA-
GTCACGCCTTTC-3'; GAPDH上游5'-TGACTTC-
AACAGCAACTC-3',下游5'-TGTAGCCATATTCA-
TTGTCA-3'。循環條件:95℃預變性8 min;95℃變性10 s、60℃退火20 s、72℃延伸25 s,40個循環。溶解曲線分析為:55~95℃,0.5℃/15 s。采用2-ΔΔCt法分析目的基因相對表達量,以GAPDH作為內參。實驗重復3次。② Western blot檢測:使用總蛋白提取試劑盒提取細胞總蛋白,BCA蛋白濃度測定試劑盒測定蛋白濃度,10%SDS-PAGE凝膠電泳,聚偏氟乙烯膜轉膜,5%脫脂奶粉封閉,稀釋一抗(抗actin抗體、抗aP2抗體、抗PPARγ抗體)4℃孵育過夜;二抗室溫孵育2 h,洗膜,用ECL試劑盒顯影。應用Quantity One軟件分析蛋白表達水平。實驗重復3 次。
1.5 統計學方法
采用SPSS13.0統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用t檢驗;檢驗水準α=0.05。
2 結果
2.1 CYD對TSCs的適用濃度篩選
2.1.1 細胞形態觀察
倒置相差顯微鏡觀察示,與對照組比較,CYD各濃度組TSCs伸展度減小,形態逐漸變圓。CYD終濃度為50、100 ng/mL時,各時間點TSCs存活未受明顯影響;終濃度為500、1 000 ng/ mL時,可見呈核固縮狀態的死亡TSCs,且死亡細胞數量隨著CYD終濃度、干預時間的增加而增加。見圖 1。鑒于此,初步選擇CYD終濃度為100 ng/mL進行后續實驗。
 圖1
各組細胞存活狀態及形態觀察(倒置相差顯微鏡×100) 從左至右分別為對照組、50 ng/mL組、100 ng/mL組、500 ng/mL組、1 000 ng/mL組 ? 培養1 h ? 培養3 d ? 培養7 d
Figure1.
The survival condition and morphology observation of cells in each group (Inverted phase contrast microscope×100) They were the control group,50 ng/mL group,100 ng/mL group,500 ng/mL group,and 1 000 ng/mL group from left to right respectively ? Cultured for 1 hour ? Cultured for 3 days ? Cultured for 7 days
圖1
各組細胞存活狀態及形態觀察(倒置相差顯微鏡×100) 從左至右分別為對照組、50 ng/mL組、100 ng/mL組、500 ng/mL組、1 000 ng/mL組 ? 培養1 h ? 培養3 d ? 培養7 d
Figure1.
The survival condition and morphology observation of cells in each group (Inverted phase contrast microscope×100) They were the control group,50 ng/mL group,100 ng/mL group,500 ng/mL group,and 1 000 ng/mL group from left to right respectively ? Cultured for 1 hour ? Cultured for 3 days ? Cultured for 7 days
2.1.2 F-actin染色
激光共聚焦顯微鏡觀察示,對照組TSCs較伸展,呈不規則多角形,熒光強,細胞骨架F-actin呈彌漫狀橘紅色熒光樣物質,分布清晰,細胞質內肌動蛋白纖維絲方向相對規則。而100 ng/ mL組TSCs在干預1 h后即出現胞體伸展度減小,形態相對圓滑,細胞骨架F-actin排列紊亂、模糊、減少,呈顆粒狀斷裂;隨著時間延長,F-actin受到的影響呈遞增趨勢。見圖 2。
 圖2
100 ng/mL組及對照組F-actin染色觀察(激光共聚焦顯微鏡×400) 從左至右分別為干預1 h、3 d、7 d ? 對照組 ? 100 ng/mL組
Figure2.
The F-actin staining observation of 100 ng/mL group and control group (Confocal laser scanning microscope×400) The intervention time was 1 hour,3 days,and 7 days from left to right respectively ? Control group ? 100 ng/mL group
圖2
100 ng/mL組及對照組F-actin染色觀察(激光共聚焦顯微鏡×400) 從左至右分別為干預1 h、3 d、7 d ? 對照組 ? 100 ng/mL組
Figure2.
The F-actin staining observation of 100 ng/mL group and control group (Confocal laser scanning microscope×400) The intervention time was 1 hour,3 days,and 7 days from left to right respectively ? Control group ? 100 ng/mL group
2.1.3 Wesrtern
blot檢測 對照組F-actin/G-actin比值為0.738±0.076,顯著高于100 ng/mL組3、7 d的0.399±0.069、0.361±0.061,比較差異均有統計學意義(t=38.333,P=0.001;t=31.405,P=0.001)。100 ng/mL組3、7 d間F-actin/G-actin比值比較,差異亦有統計學意義(t=8.130,P=0.015)。
根據上述實驗結果,提示CYD終濃度為100 ng/ mL時既可有效干擾TSCs細胞骨架F-actin的聚合,又不影響TSCs的存活,確定以該濃度用于進一步研究。
2.2 CYD對TSCs成脂分化的影響
2.2.1 成脂誘導培養基培養
實時熒光定量PCR檢測示,3、7 d時CYD+誘導組PPARγ、LPL和aP2基因相對表達量顯著高于誘導組,比較差異有統計學意義(P<0.05)。各基因相對表達量隨CYD干預時間延長呈遞增趨勢,比較差異有統計學意義(P<0.05)。見圖 3。
 圖3
實時熒光定量PCR檢測CYD+誘導組和誘導組PPARγ、LPL、aP2基因表達 ? PPARγ ? LPL ? aP2? ?圖 4 Western blot檢測CYD+誘導組和誘導組PPARγ、aP2蛋白表達 ? 電泳圖 1:誘導組 2:CYD+誘導組 ? aP2蛋白表達水平 PPARγ蛋白表達水平? ?圖 5 實時定量PCR檢測CYD+普通組和普通組PPARγ、LPL、aP2基因表達 ? PPARγ ? LPL ? aP2
Figure3.
The mRNA expressions of PPARγ,LPL,and aP2 in CYD+induction group and induction group by real-time quantitative PCR ? PPARγ ? LPL ? aP2? ? Fig. 4 The protein expressions of PPARγ and aP2 in CYD+induction group and induction group by Western blot ? Electrophoretogram 1: Induction group 2: CYD+induction group Protein expression of PPARγ ? Protein expression of aP2? ? Fig. 5 The mRNA expressions of PPARγ,LPL,and aP2 in CYD+ordinary group and ordinary group by real-time quantitative PCR ? PPARγ ? LPL ? aP2
圖3
實時熒光定量PCR檢測CYD+誘導組和誘導組PPARγ、LPL、aP2基因表達 ? PPARγ ? LPL ? aP2? ?圖 4 Western blot檢測CYD+誘導組和誘導組PPARγ、aP2蛋白表達 ? 電泳圖 1:誘導組 2:CYD+誘導組 ? aP2蛋白表達水平 PPARγ蛋白表達水平? ?圖 5 實時定量PCR檢測CYD+普通組和普通組PPARγ、LPL、aP2基因表達 ? PPARγ ? LPL ? aP2
Figure3.
The mRNA expressions of PPARγ,LPL,and aP2 in CYD+induction group and induction group by real-time quantitative PCR ? PPARγ ? LPL ? aP2? ? Fig. 4 The protein expressions of PPARγ and aP2 in CYD+induction group and induction group by Western blot ? Electrophoretogram 1: Induction group 2: CYD+induction group Protein expression of PPARγ ? Protein expression of aP2? ? Fig. 5 The mRNA expressions of PPARγ,LPL,and aP2 in CYD+ordinary group and ordinary group by real-time quantitative PCR ? PPARγ ? LPL ? aP2
Western blot檢測示,3、7 d時CYD+誘導組PPARγ、aP2蛋白相對表達量顯著高于誘導組,比較差異有統計學意義(P<0.05);并且相對表達量隨CYD干預時間的延長有遞增趨勢,比較差異亦有統計學意義(P<0.05)。見圖 4。
2.2.2 普通培養基培養
實時熒光定量PCR檢測示,3、7 d時CYD+普通組PPARγ、LPL和aP2基因相對表達量顯著高于普通組,比較差異有統計學意義(P<0.05);且LPL、aP2基因的相對表達量隨CYD干預時間的延長呈遞增趨勢,比較差異有統計學意義(P<0.05);PPARγ基因相對表達量在CYD干預3 d和7 d時比較差異無統計學意義(P>0.05)。見圖 5。
3 討論
細胞骨架是維持細胞形態的關鍵結構,其動態變化在細胞黏附、遷移、凋亡、細胞周期、信號轉導等生理過程中均有著重要作用[13-15],主要由微管、微絲及中間纖維共同構成。其中,微絲是由F-actin聚合形成,與肌動蛋白結合蛋白交聯以形成網絡狀結構[16],作為一種應力纖維,在機械牽伸等力學刺激應答過程中起關鍵作用。有研究報道,在力學刺激信號由細胞外基質向細胞內轉導過程中,通過形成一個“細胞外基質-整合素-細胞骨架-細胞核”的網架系統,細胞外的機械力信號可沿此“軌道”傳導,進而使細胞對該力學刺激發生一系列后續反應[17-18]。除了感受力學刺激外,細胞骨架還能將力學信號轉換為化學信號。當肌動蛋白纖維收縮時,細胞骨架相關蛋白也會受到牽伸,此時便會出現一些新的細胞骨架相關蛋白結合位點,進而使一些信號蛋白發生磷酸化而被激活[19]。隨著對干細胞研究的深入,有學者發現細胞骨架在調控干細胞分化功能方面也起著重要作用[20]。有研究證實當聚集成團生長時,細胞多接近呈圓形,更容易向軟骨細胞分化[21];當MSCs形態被干預成圓形時,多向成脂肪分化;而當MSCs伸展開后,則更傾向于成骨分化[22]。
本研究探討了細胞骨架在TSCs成脂分化過程中的作用。首先從大鼠跟腱中分離出TSCs,并通過觀察細胞呈鵝卵石樣聚集生長,檢測干細胞表面標志物CD90、CD44、Oct-4以及成功誘導其成骨、成軟骨、成脂肪分化,證實了所培養細胞為TSCs[10]。然后通過濃度篩選實驗,在不影響TSCs存活狀態的前提下,使用CYD干預TSCs培養,結果顯示:100 ng/mL終濃度的CYD可有效干擾TSCs細胞骨架F-actin的聚合,并且隨著干預時間延長,F-actin受到的影響呈遞增趨勢。隨后在TSCs成脂誘導培養過程中,通過使用CYD干擾其細胞骨架F-actin的聚合發現:相對于單純的TSCs成脂誘導培養,CYD干預可明顯促進TSCs成脂誘導培養的誘導效率。表明細胞骨架的變化參與了TSCs成脂分化的調控,但是其在TSCs成脂分化過程中的作用究竟是協同增強成脂誘導培養基的誘導作用,還是可單獨啟動TSCs向成脂方向分化尚不清楚。為此,我們進一步在TSCs普通培養過程中使用CYD干擾其細胞骨架F-actin的聚合,發現在無誘導因素情況下,單純CYD干預也可明顯促進TSCs成脂分化。表明細胞骨架的變化是導致TSCs發生成脂分化的誘導啟動因素。上述實驗結果與CYD干預能促進MSCs成脂分化是一致的[23],并且進一步深化了我們課題組前期研究發現:8%牽伸應變量對TSCs能產生過度牽伸效果,并且可使TSCs中RhoA/Rho相關蛋白激酶(Rho as soc iat ed protein kinases,ROCK)分子表達顯著升高[24],而RhoA/ROCK分子具有機械敏感性[25],當受到外界應力時,RhoA/ROCK通過調節細胞骨架重塑,導致干細胞發生形狀變化,使干細胞向不同方向分化[22]。
綜上述,在TSCs成脂分化過程中,細胞骨架的變化起著非常重要的作用,它不是TSCs成脂分化的一個結果,而是導致TSCs成脂分化的早期細胞內改變之一。這表明機械牽伸載荷有可能是通過影響細胞骨架和細胞形態改變,進而影響TSCs的分化方向,為肌腱病發病機制研究及治療提供了新思路。但本研究目前只研究了細胞骨架對TSCs成脂分化的調控作用,對于細胞骨架在TSCs向其他方向分化時的影響以及細胞骨架上下游的調控信號分子尚需進一步研究。