引用本文: 趙璇, 白玨, 游思維, 崔媛媛, 武明媚. 依托咪酯對機械性損傷的體外培養視網膜神經節細胞的保護作用. 中華眼底病雜志, 2023, 39(6): 489-493. doi: 10.3760/cma.j.cn511434-20211021-00595 復制
視神經損傷可導致視網膜神經節細胞(RGC)的死亡和視覺功能喪失。有效促進RGC存活是修復視神經損傷的關鍵,藥物治療是保護損傷RGC的有效方法之一。依托咪酯(ET)是一種非巴比妥類靜脈麻醉藥,可選擇性作用于含有β2或β3亞單位的γ-氨基丁酸A型受體,促進Cl-內流,從而使細胞膜超極化而發揮麻醉作用[1]。近年研究發現,ET具有一定神經保護作用,可減輕前腦缺血大鼠海馬神經元的損傷,對海人藻酸引起的大鼠海馬神經元損傷具有保護作用,可促進大鼠脊髓損傷后的脊髓功能恢復[2-4]。我們課題組前期發現ET在大鼠視神經橫斷損傷后7 d對RGC具有保護作用[5-6],其保護作用與損傷后早期的抗氧化應激相關[6]。另有多項研究也發現ET具有抗氧化應激作用[4, 7-10]。然而,關于ET抗氧化應激反應的機制及其與劑量的關系尚不清楚。為此,本研究采用機械性劃傷原代培養RGC方法建立體外損傷模型,觀察不同劑量的ET對體外機械性損傷的RGC是否具有保護作用及其量效關系。現將結果報道如下。
1 材料和方法
1.1 材料
Neurobasal-A、胎牛血清、胰蛋白酶、谷胺酰胺和B27(美國Gibco公司);TritonX-100MP(美國MP Biomedicals公司);戊巴比妥鈉、多聚賴氨酸(美國Sigma公司);ET乳狀注射液(江蘇恩華藥業股份有限公司);細胞計數試劑盒-8(CCK-8)(上海尚寶生物科技有限公司);膜聯蛋白(Annexin)Ⅴ/碘化丙啶(PI)凋亡試劑盒(上海七海復泰生物科技有限公司);Thy1.1、微管關聯蛋白2(MAP2)抗體(美國Millipore公司);Alexa Fluor 594、Alexa Fluor 488羊抗兔抗體(美國Jackson ImmunoResearch公司)。
1.2 原代RGC培養、鑒定
健康新生Sprague-Dawley(SD)大鼠20只,0~3 d齡,空軍軍醫大學實驗動物中心提供。實驗動物飼養及操作均遵循國家科學技術委員會《實驗動物管理條例》的規定。并獲得空軍軍醫大學實驗動物福利與倫理委員會許可(倫理審批號:IACUC-20210123)。
SD大鼠麻醉后處死,摘除眼球,分離視網膜,剪碎,0.25%胰蛋白酶消化,含10%胎牛血清的Dulbecco改良Eagle培養液終止消化,吸管反復吹打成細胞懸液。細胞懸液過濾,離心,棄上清,加入Neurobasal-A神經元培養基(含2%B27、2 mmol/L谷胺酰胺),吸管吹打成單細胞懸液。錐蟲藍染色細胞計數,以總數5×105個/孔(用于CCK-8實驗)和2×106個/孔(用于細胞凋亡檢測實驗)分別接種于24孔和6孔培養板,37℃、5%CO2培養箱中孵育。
采用免疫熒光法鑒定原代大鼠RGC。RGC培養至7 d時,取出長滿細胞的蓋玻片,4%多聚甲醛固定4 h;3%牛血清白蛋白-0.3%Triton-X100封閉30 min;MAP2(1:1 000)、Thy1.1(1:100)一抗4 ℃孵育過夜;Alexa Fluor 594/488羊抗兔抗體標記的二抗(1:800)孵育2 h;50%甘油封片,熒光顯微鏡下觀察。采用倒置相差顯微鏡觀察培養24 h及4、7 d時RGC生長情況。
1.3 RGC機械性損傷模型建立與分組
細胞培養至7 d,融合度達80%時,將細胞分為對照組、RGC劃傷組、ET低劑量組、ET中劑量組、ET高劑量組。對照組:神經元培養基常規培養,不作任何處理;RGC劃傷組:使用虹膜刀以每隔約5 mm距離劃傷培養的RGC;ET低劑量組、ET中劑量組、ET高劑量組:劃傷RGC后,各孔立即分別加入終濃度為1、5、10 μmol/L的ET。
1.4 CCK-8增生分析法檢測各組RGC活性
建模后7 d,每孔加入50 μl CCK-8,培養箱中孵育4 h后各孔中吸取200 μl培養液轉入96孔板,酶標儀上以450 nm波長測定對照組、RGC劃傷組和不同濃度ET組細胞的吸光度[A,舊稱光密度(OD)]值。細胞存活率(%)=(A干預—A空白對照)/(A0干預—A空白對照)×100%,其中A0干預為具有RGC、CCK溶液而未進行機械性損傷的A值。每組重復6孔。
1.5 AnnexinⅤ/PI雙染色法檢測各組RGC凋亡情況
建模后7 d,0.125%胰蛋白酶(不含乙二胺四乙酸)消化,待細胞突起回縮后立即終止消化,離心;100 μl結合緩沖液重懸細胞,加入10 μl Annexin V/熒光素異硫氰酸酯冰上避光孵育15 min;加入400 μl結合緩沖液、5 μl PI冰上避光孵育5 min;混勻流式細胞儀檢測細胞凋亡率。每組重復3孔。
1.6 統計學分析
采用SPSS13.0軟件行統計學分析。計量資料以均數±標準差( ±s)表示。多組間比較采用單因素方差分析;組間兩兩比較采用最小顯著差法檢驗。P<0.05為差異有統計學意義。
±s)表示。多組間比較采用單因素方差分析;組間兩兩比較采用最小顯著差法檢驗。P<0.05為差異有統計學意義。
2 結果
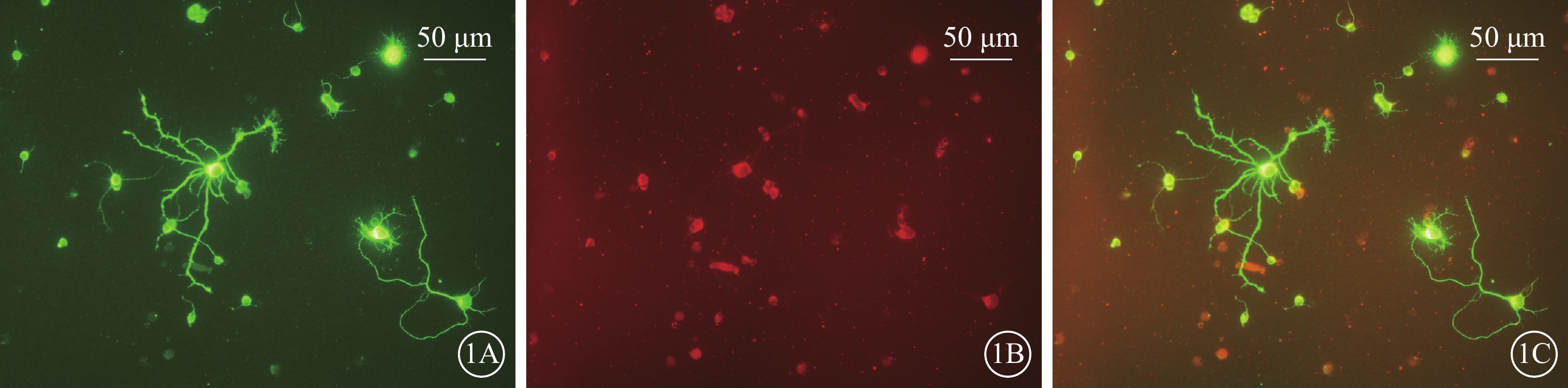
熒光顯微鏡觀察發現,MAP2標記的陽性神經元胞體和突起呈綠色熒光,Thy1.1標記的陽性神經元胞體呈紅色熒光,雙標陽性神經元呈黃色熒光為RGC,部分雙標陽性神經元由于綠色熒光較強呈綠色熒光。熒光雙標顯示MAP2和Thy1.1標記的細胞高度一致(圖1)。
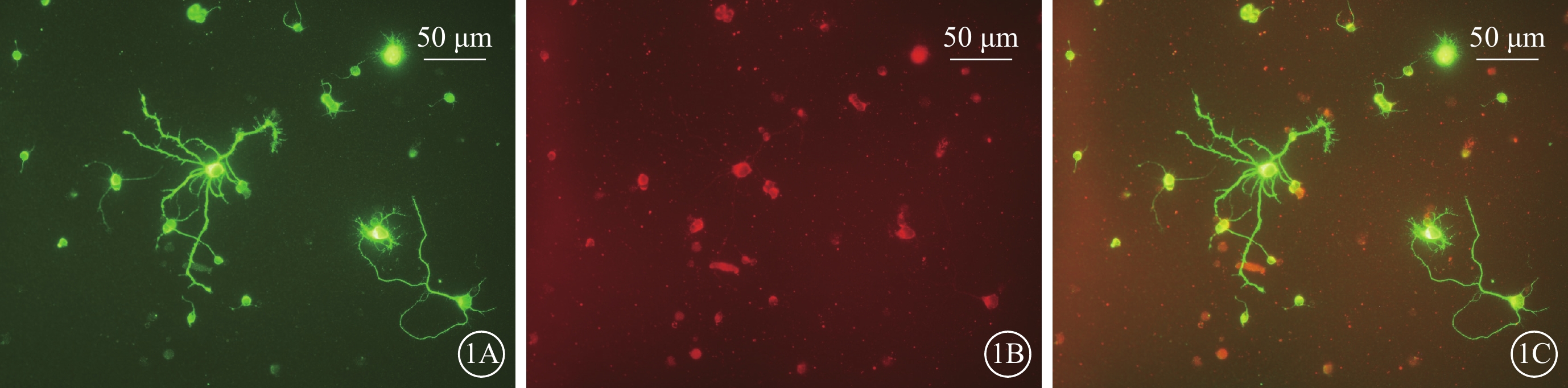 圖1
原代培養視網膜神經節細胞熒光顯微鏡像 1A~1C分別示MAP2陽性神經元、Thy1.1陽性神經元、雙標神經元 標尺:50 μm
圖1
原代培養視網膜神經節細胞熒光顯微鏡像 1A~1C分別示MAP2陽性神經元、Thy1.1陽性神經元、雙標神經元 標尺:50 μm
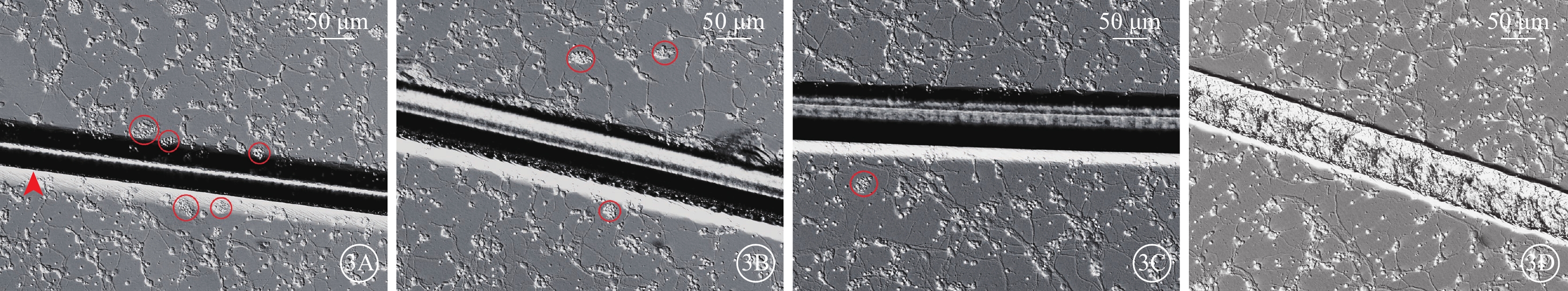
倒置相差顯微鏡觀察發現,RGC原代培養24 h后即可長出突起,培養4 d時突起增長,少數細胞之間的突起相互連接;培養7 d時突起進一步增長,相互連接的突起也明顯增多,細胞融合度約80%(圖2)。RGC劃傷組劃痕邊緣及劃痕附近區域可見聚集成群的死亡細胞碎片;不同劑量ET組死亡細胞碎片群有所減少,其中ET中劑量組、ET高劑量組減少較為明顯(圖3)。
 圖2
原代培養視網膜神經節細胞倒置相差顯微鏡像 2A示培養4 d,突起增長,少數細胞之間的突起相互連接;2B示培養7 d,突起進一步增長,相互連接的突起也明顯增多 標尺:20 μm
圖2
原代培養視網膜神經節細胞倒置相差顯微鏡像 2A示培養4 d,突起增長,少數細胞之間的突起相互連接;2B示培養7 d,突起進一步增長,相互連接的突起也明顯增多 標尺:20 μm
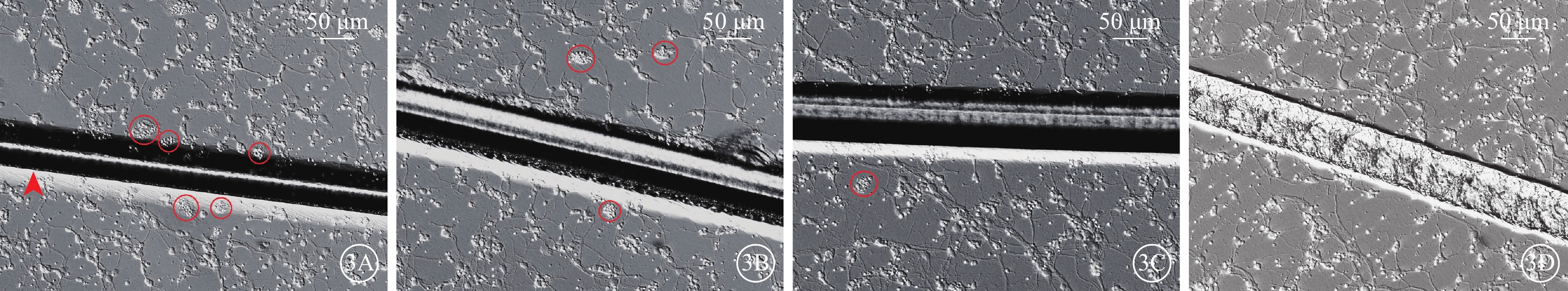 圖3
原代培養RGC倒置相差顯微鏡像 RGC:視網膜神經節細胞;ET:依托咪酯;ET低劑量組:劃傷+1 μmol/L ET;ET中劑量組:劃傷+5 μmol/L ET;ET高劑量組:劃傷+10 μmol/L ET。3A~3D分別示RGC劃傷組、ET低劑量組、ET中劑量組、ET高劑量組。RGC劃傷組劃痕(紅箭頭)邊緣及劃痕附近區域可見聚集成群的死亡細胞碎片(紅圈);不同劑量ET組死亡細胞碎片群有所減少,其中ET中劑量組、ET高劑量組減少較為明顯 標尺:50 μm
圖3
原代培養RGC倒置相差顯微鏡像 RGC:視網膜神經節細胞;ET:依托咪酯;ET低劑量組:劃傷+1 μmol/L ET;ET中劑量組:劃傷+5 μmol/L ET;ET高劑量組:劃傷+10 μmol/L ET。3A~3D分別示RGC劃傷組、ET低劑量組、ET中劑量組、ET高劑量組。RGC劃傷組劃痕(紅箭頭)邊緣及劃痕附近區域可見聚集成群的死亡細胞碎片(紅圈);不同劑量ET組死亡細胞碎片群有所減少,其中ET中劑量組、ET高劑量組減少較為明顯 標尺:50 μm
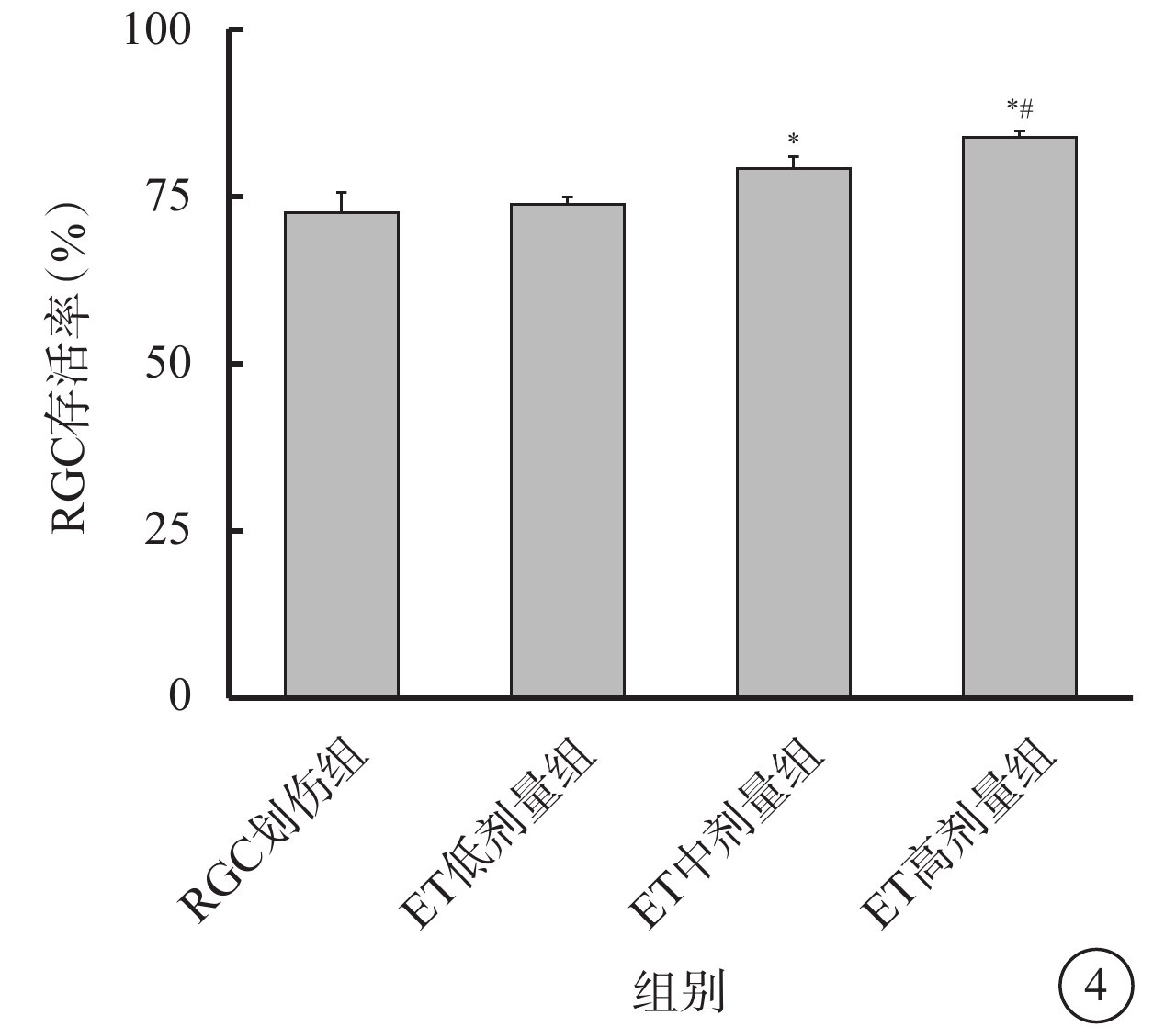
CCK-8增生分析法結果顯示,建模后7 d,RGC劃傷組、ET低劑量組、ET中劑量組、ET高劑量組RGC存活率分別為(72.60±2.97)%、(73.73±1.14)%、(79.19±1.79)%、(83.88±0.94)%;ET低劑量組、ET中劑量組、ET高劑量組RGC存活率提高,差異有統計學意義(F=45.892,P<0.001)。組間兩兩比較,RGC劃傷組與ET低劑量組之間的差異無統計學意義(P=0.728);RGC劃傷組與ET中劑量組、ET高劑量組之間的差異均有統計學意義(P<0.001);ET中劑量組與ET高劑量組之間的差異有統計學意義(P=0.002)(圖4)。
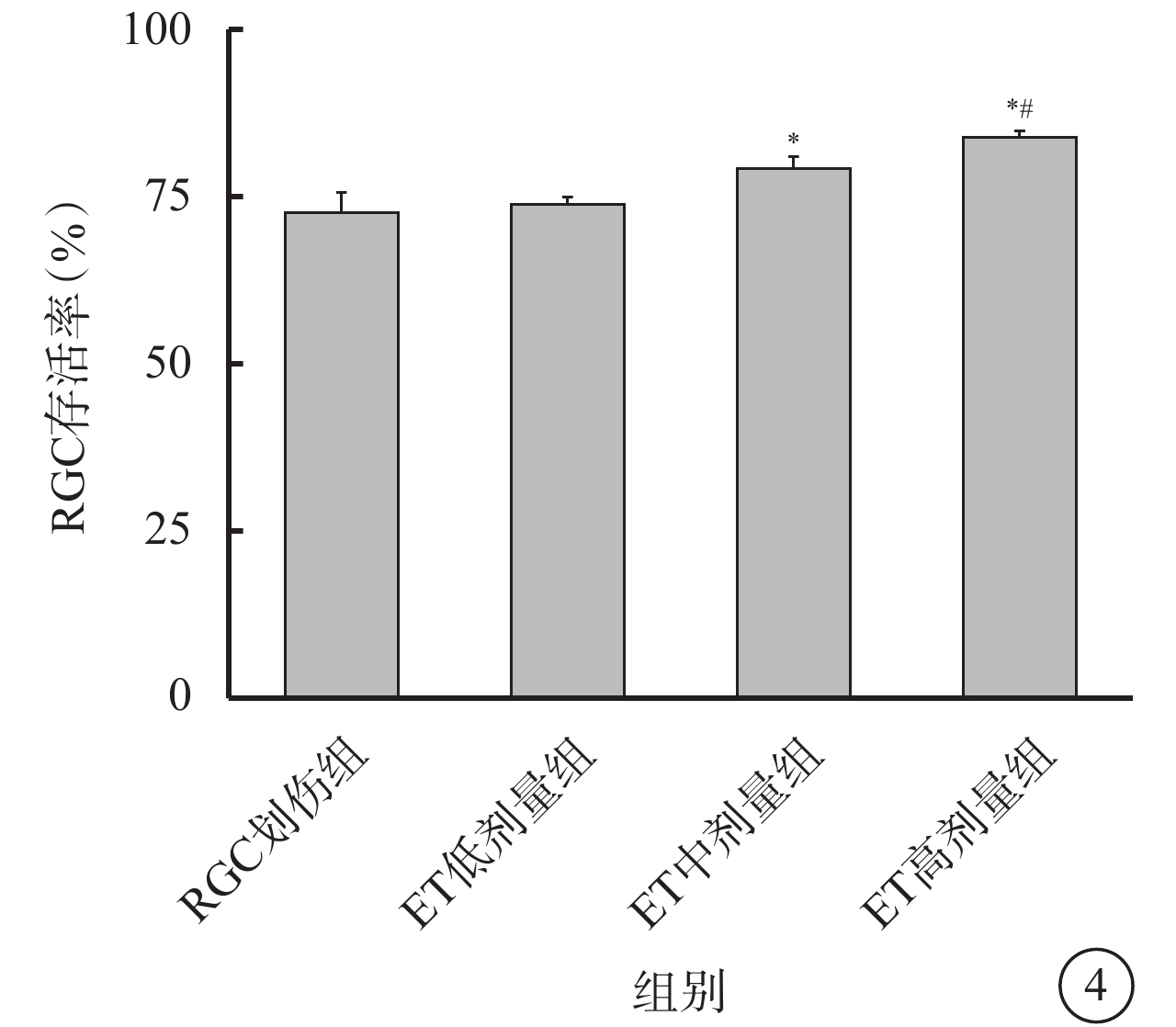 圖4
各組RGC存活率比較(n=6) RGC:視網膜神經節細胞;ET:依托咪酯;ET低劑量組:劃傷+1 μmol/L ET;ET中劑量組:劃傷+5 μmol/L ET;ET高劑量組:劃傷+10μmol/L ET。*與RGC劃傷組比較,P<0.05;#與ET低劑量組比較,P<0.05
圖4
各組RGC存活率比較(n=6) RGC:視網膜神經節細胞;ET:依托咪酯;ET低劑量組:劃傷+1 μmol/L ET;ET中劑量組:劃傷+5 μmol/L ET;ET高劑量組:劃傷+10μmol/L ET。*與RGC劃傷組比較,P<0.05;#與ET低劑量組比較,P<0.05
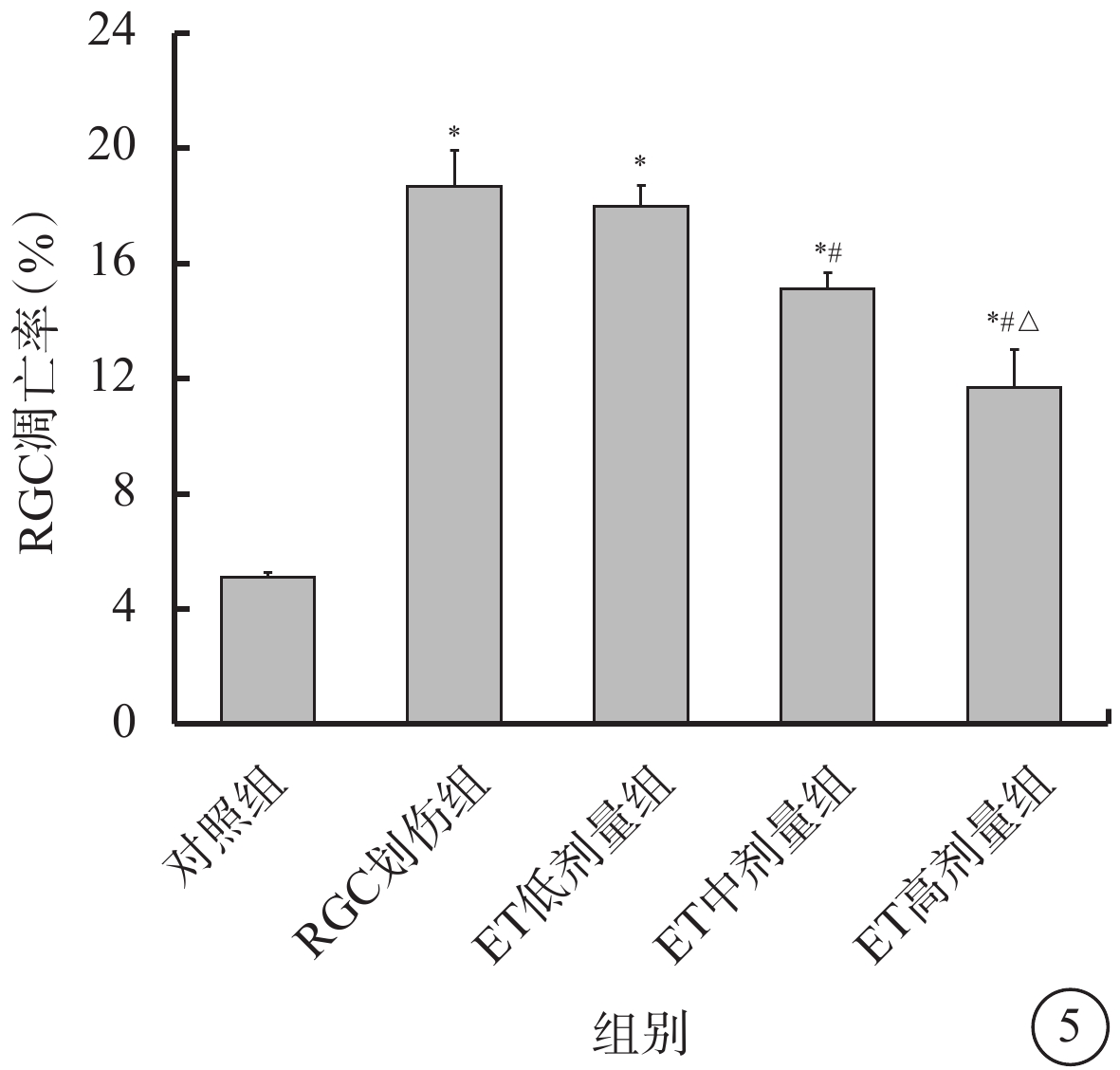
流式細胞儀檢測結果顯示,建模后7 d,對照組、RGC劃傷組、ET低劑量組、ET中劑量組、ET高劑量組RGC凋亡率分別為(5.08±0.17)%、(18.67±1.24)%、(17.96±0.74)%、(15.11±0.56)%、(11.67±1.32)%;RGC劃傷組、ET低劑量組、ET中劑量組、ET高劑量組RGC凋亡率較對照組顯著增高,差異有統計學意義(F=132.371,P<0.001)。組間兩兩比較,RGC劃傷組凋亡率較對照組顯著升高,差異有統計學意義(P<0.001);與RGC劃傷組比較,ET低劑量組與之差異無統計學意義(P=0.869),ET中劑量組、ET高劑量組RGC凋亡率顯著降低,差異均有統計學意義(P<0.05);與ET中劑量組比較,ET高劑量組RGC凋亡率進一步降低,差異有統計學意義(P=0.007)(圖5)。
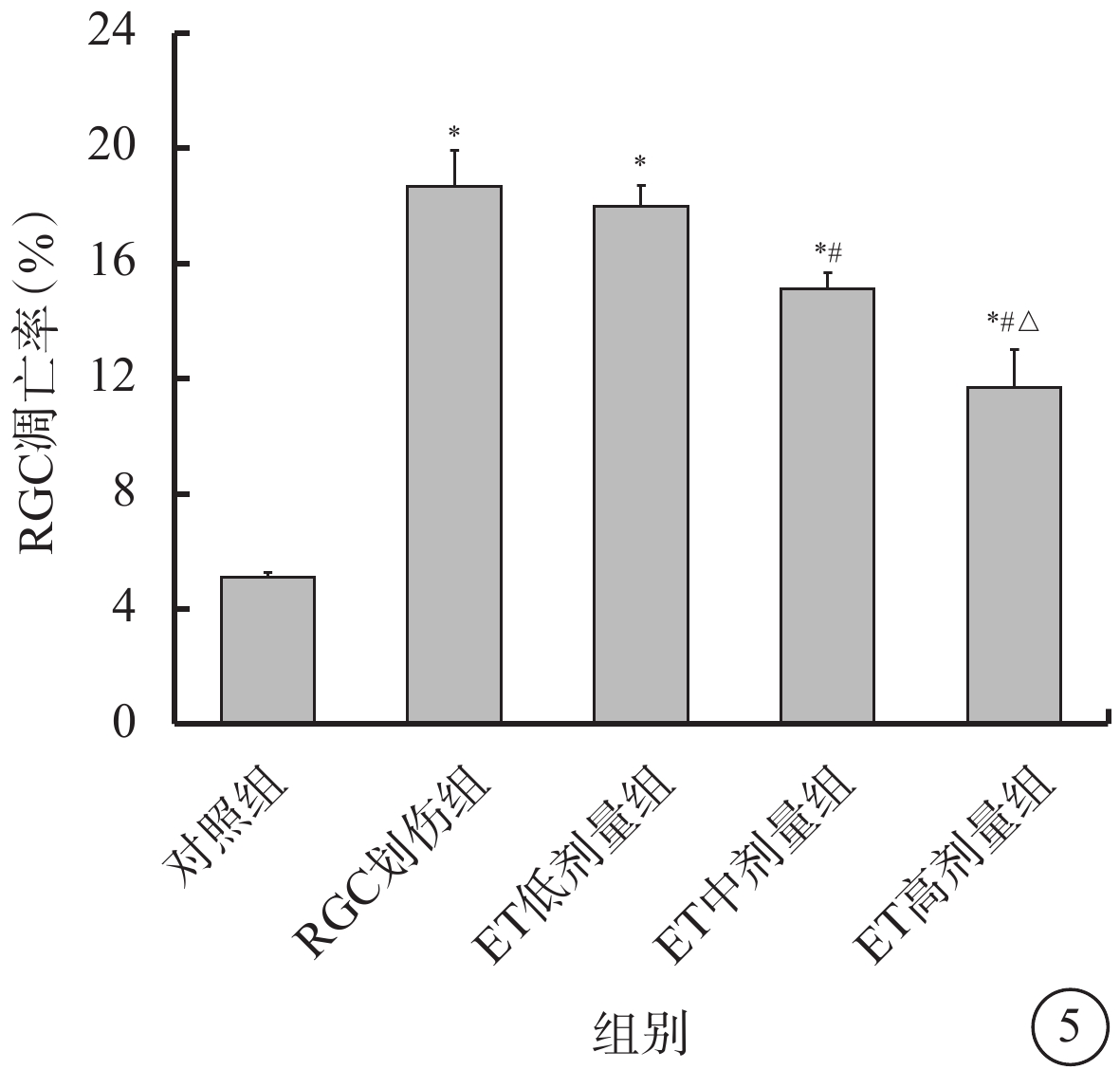 圖5
各組RGC凋亡率比較(n=3) RGC:視網膜神經節細胞;ET:依托咪酯;ET低劑量組:劃傷+1 μmol/L ET;ET中劑量組:劃傷+5 μmol/L ET;ET高劑量組:劃傷+10μmol/L ET。*與對照組比較,P<0.05;#與RGC劃傷組比較,P<0.05;△與ET中劑量組比較,P<0.05
圖5
各組RGC凋亡率比較(n=3) RGC:視網膜神經節細胞;ET:依托咪酯;ET低劑量組:劃傷+1 μmol/L ET;ET中劑量組:劃傷+5 μmol/L ET;ET高劑量組:劃傷+10μmol/L ET。*與對照組比較,P<0.05;#與RGC劃傷組比較,P<0.05;△與ET中劑量組比較,P<0.05
3 討論
本研究以神經元培養基原代培養出生后0~3 d的SD大鼠RGC。Thy1.1抗原是細胞表面的一種糖蛋白,表達于嚙齒類動物多種細胞,高表達于大鼠的腦和胸腺。視網膜內Thy1.1特異性表達于RGC,但體外培養時尚可發現Thy1.1染色陽性的成纖維細胞[11-12]。MAP2是成熟神經元的標記物,成纖維細胞不表達MAP2。因此,本研究采用Thy1.1和MAP2進行免疫熒光雙標染色對培養7 d的RGC進行鑒定。結果顯示,Thy1.1陽性細胞和MAP2陽性細胞高度一致,證明雙標細胞為原代培養的RGC。
倒置相差顯微鏡觀察發現,RGC原代培養24 h后即可長出突起,培養4 d時突起增長,少數細胞之間的突起相互連接;培養7 d時突起進一步增長,相互連接的突起也明顯增多,細胞融合度約80%。因此本研究選擇培養7 d時的細胞進行體外實驗。視神經由RGC的軸突構成,在體實驗中橫斷視神經是將RGC的軸突切斷,因此可通過機械性損傷體外培養的RGC來模擬在體視神經損傷。已有多項研究采用機械性劃傷培養神經元的突起而成功構建體外神經損傷模型[13-15]。本研究按照Wang等[15]方法采用虹膜刀劃傷RGC的突起模擬視神經損傷。ET的臨床使用濃度為1~10 μmol/L[16],為觀察不同濃度ET對損傷RGC的作用,本研究分別選取1、5、10 μmol/L作為低、中、高劑量進行實驗。參照ET的在體實驗,體外實驗中我們選擇劃傷RGC后7 d作為觀察時間點。
本研究結果顯示,劃傷RGC后,劃痕邊緣及附近區域可見較多成群分布的死亡細胞碎片。劃傷后給予中、高劑量ET處理,可減少死亡細胞碎片群的數量。CCK-8增生分析法結果顯示,低劑量ET未能提高細胞存活率,而中、高劑量ET可顯著提高細胞存活率;與中劑量ET作用比較,高劑量ET作用下細胞存活率更高,差異有統計學意義,呈現出量效關系。正常培養RGC過程中有少量細胞發生凋亡。Annexin Ⅴ/PI雙染色結果顯示,與對照組比較,建模后7 d,RGC劃傷組細胞凋亡率顯著增高,不同劑量ET干預后,低劑量ET未能減少細胞凋亡率,而中、高劑量ET可顯著降低細胞凋亡率。與中劑量ET作用比較,高劑量ET降低細胞凋亡率的作用更為顯著并呈量效關系。因此,低劑量ET對損傷RGC缺乏神經保護作用,而5、10 μmol/L的ET對劃傷的RGC具有呈量效關系的神經保護作用。
本研究結果表明,ET對體外機械性損傷的RGC具有神經保護作用,但具體作用機制我們未能進行探索。結合我們前期體內實驗發現的結論,即抗氧化應激參與了ET的神經保護作用[6],今后我們將針對ET的體外神經保護作用與抗氧化應激的關系進行深入探討。
視神經損傷可導致視網膜神經節細胞(RGC)的死亡和視覺功能喪失。有效促進RGC存活是修復視神經損傷的關鍵,藥物治療是保護損傷RGC的有效方法之一。依托咪酯(ET)是一種非巴比妥類靜脈麻醉藥,可選擇性作用于含有β2或β3亞單位的γ-氨基丁酸A型受體,促進Cl-內流,從而使細胞膜超極化而發揮麻醉作用[1]。近年研究發現,ET具有一定神經保護作用,可減輕前腦缺血大鼠海馬神經元的損傷,對海人藻酸引起的大鼠海馬神經元損傷具有保護作用,可促進大鼠脊髓損傷后的脊髓功能恢復[2-4]。我們課題組前期發現ET在大鼠視神經橫斷損傷后7 d對RGC具有保護作用[5-6],其保護作用與損傷后早期的抗氧化應激相關[6]。另有多項研究也發現ET具有抗氧化應激作用[4, 7-10]。然而,關于ET抗氧化應激反應的機制及其與劑量的關系尚不清楚。為此,本研究采用機械性劃傷原代培養RGC方法建立體外損傷模型,觀察不同劑量的ET對體外機械性損傷的RGC是否具有保護作用及其量效關系。現將結果報道如下。
1 材料和方法
1.1 材料
Neurobasal-A、胎牛血清、胰蛋白酶、谷胺酰胺和B27(美國Gibco公司);TritonX-100MP(美國MP Biomedicals公司);戊巴比妥鈉、多聚賴氨酸(美國Sigma公司);ET乳狀注射液(江蘇恩華藥業股份有限公司);細胞計數試劑盒-8(CCK-8)(上海尚寶生物科技有限公司);膜聯蛋白(Annexin)Ⅴ/碘化丙啶(PI)凋亡試劑盒(上海七海復泰生物科技有限公司);Thy1.1、微管關聯蛋白2(MAP2)抗體(美國Millipore公司);Alexa Fluor 594、Alexa Fluor 488羊抗兔抗體(美國Jackson ImmunoResearch公司)。
1.2 原代RGC培養、鑒定
健康新生Sprague-Dawley(SD)大鼠20只,0~3 d齡,空軍軍醫大學實驗動物中心提供。實驗動物飼養及操作均遵循國家科學技術委員會《實驗動物管理條例》的規定。并獲得空軍軍醫大學實驗動物福利與倫理委員會許可(倫理審批號:IACUC-20210123)。
SD大鼠麻醉后處死,摘除眼球,分離視網膜,剪碎,0.25%胰蛋白酶消化,含10%胎牛血清的Dulbecco改良Eagle培養液終止消化,吸管反復吹打成細胞懸液。細胞懸液過濾,離心,棄上清,加入Neurobasal-A神經元培養基(含2%B27、2 mmol/L谷胺酰胺),吸管吹打成單細胞懸液。錐蟲藍染色細胞計數,以總數5×105個/孔(用于CCK-8實驗)和2×106個/孔(用于細胞凋亡檢測實驗)分別接種于24孔和6孔培養板,37℃、5%CO2培養箱中孵育。
采用免疫熒光法鑒定原代大鼠RGC。RGC培養至7 d時,取出長滿細胞的蓋玻片,4%多聚甲醛固定4 h;3%牛血清白蛋白-0.3%Triton-X100封閉30 min;MAP2(1:1 000)、Thy1.1(1:100)一抗4 ℃孵育過夜;Alexa Fluor 594/488羊抗兔抗體標記的二抗(1:800)孵育2 h;50%甘油封片,熒光顯微鏡下觀察。采用倒置相差顯微鏡觀察培養24 h及4、7 d時RGC生長情況。
1.3 RGC機械性損傷模型建立與分組
細胞培養至7 d,融合度達80%時,將細胞分為對照組、RGC劃傷組、ET低劑量組、ET中劑量組、ET高劑量組。對照組:神經元培養基常規培養,不作任何處理;RGC劃傷組:使用虹膜刀以每隔約5 mm距離劃傷培養的RGC;ET低劑量組、ET中劑量組、ET高劑量組:劃傷RGC后,各孔立即分別加入終濃度為1、5、10 μmol/L的ET。
1.4 CCK-8增生分析法檢測各組RGC活性
建模后7 d,每孔加入50 μl CCK-8,培養箱中孵育4 h后各孔中吸取200 μl培養液轉入96孔板,酶標儀上以450 nm波長測定對照組、RGC劃傷組和不同濃度ET組細胞的吸光度[A,舊稱光密度(OD)]值。細胞存活率(%)=(A干預—A空白對照)/(A0干預—A空白對照)×100%,其中A0干預為具有RGC、CCK溶液而未進行機械性損傷的A值。每組重復6孔。
1.5 AnnexinⅤ/PI雙染色法檢測各組RGC凋亡情況
建模后7 d,0.125%胰蛋白酶(不含乙二胺四乙酸)消化,待細胞突起回縮后立即終止消化,離心;100 μl結合緩沖液重懸細胞,加入10 μl Annexin V/熒光素異硫氰酸酯冰上避光孵育15 min;加入400 μl結合緩沖液、5 μl PI冰上避光孵育5 min;混勻流式細胞儀檢測細胞凋亡率。每組重復3孔。
1.6 統計學分析
采用SPSS13.0軟件行統計學分析。計量資料以均數±標準差( ±s)表示。多組間比較采用單因素方差分析;組間兩兩比較采用最小顯著差法檢驗。P<0.05為差異有統計學意義。
±s)表示。多組間比較采用單因素方差分析;組間兩兩比較采用最小顯著差法檢驗。P<0.05為差異有統計學意義。
2 結果
熒光顯微鏡觀察發現,MAP2標記的陽性神經元胞體和突起呈綠色熒光,Thy1.1標記的陽性神經元胞體呈紅色熒光,雙標陽性神經元呈黃色熒光為RGC,部分雙標陽性神經元由于綠色熒光較強呈綠色熒光。熒光雙標顯示MAP2和Thy1.1標記的細胞高度一致(圖1)。
 圖1
原代培養視網膜神經節細胞熒光顯微鏡像 1A~1C分別示MAP2陽性神經元、Thy1.1陽性神經元、雙標神經元 標尺:50 μm
圖1
原代培養視網膜神經節細胞熒光顯微鏡像 1A~1C分別示MAP2陽性神經元、Thy1.1陽性神經元、雙標神經元 標尺:50 μm
倒置相差顯微鏡觀察發現,RGC原代培養24 h后即可長出突起,培養4 d時突起增長,少數細胞之間的突起相互連接;培養7 d時突起進一步增長,相互連接的突起也明顯增多,細胞融合度約80%(圖2)。RGC劃傷組劃痕邊緣及劃痕附近區域可見聚集成群的死亡細胞碎片;不同劑量ET組死亡細胞碎片群有所減少,其中ET中劑量組、ET高劑量組減少較為明顯(圖3)。
 圖2
原代培養視網膜神經節細胞倒置相差顯微鏡像 2A示培養4 d,突起增長,少數細胞之間的突起相互連接;2B示培養7 d,突起進一步增長,相互連接的突起也明顯增多 標尺:20 μm
圖2
原代培養視網膜神經節細胞倒置相差顯微鏡像 2A示培養4 d,突起增長,少數細胞之間的突起相互連接;2B示培養7 d,突起進一步增長,相互連接的突起也明顯增多 標尺:20 μm
 圖3
原代培養RGC倒置相差顯微鏡像 RGC:視網膜神經節細胞;ET:依托咪酯;ET低劑量組:劃傷+1 μmol/L ET;ET中劑量組:劃傷+5 μmol/L ET;ET高劑量組:劃傷+10 μmol/L ET。3A~3D分別示RGC劃傷組、ET低劑量組、ET中劑量組、ET高劑量組。RGC劃傷組劃痕(紅箭頭)邊緣及劃痕附近區域可見聚集成群的死亡細胞碎片(紅圈);不同劑量ET組死亡細胞碎片群有所減少,其中ET中劑量組、ET高劑量組減少較為明顯 標尺:50 μm
圖3
原代培養RGC倒置相差顯微鏡像 RGC:視網膜神經節細胞;ET:依托咪酯;ET低劑量組:劃傷+1 μmol/L ET;ET中劑量組:劃傷+5 μmol/L ET;ET高劑量組:劃傷+10 μmol/L ET。3A~3D分別示RGC劃傷組、ET低劑量組、ET中劑量組、ET高劑量組。RGC劃傷組劃痕(紅箭頭)邊緣及劃痕附近區域可見聚集成群的死亡細胞碎片(紅圈);不同劑量ET組死亡細胞碎片群有所減少,其中ET中劑量組、ET高劑量組減少較為明顯 標尺:50 μm
CCK-8增生分析法結果顯示,建模后7 d,RGC劃傷組、ET低劑量組、ET中劑量組、ET高劑量組RGC存活率分別為(72.60±2.97)%、(73.73±1.14)%、(79.19±1.79)%、(83.88±0.94)%;ET低劑量組、ET中劑量組、ET高劑量組RGC存活率提高,差異有統計學意義(F=45.892,P<0.001)。組間兩兩比較,RGC劃傷組與ET低劑量組之間的差異無統計學意義(P=0.728);RGC劃傷組與ET中劑量組、ET高劑量組之間的差異均有統計學意義(P<0.001);ET中劑量組與ET高劑量組之間的差異有統計學意義(P=0.002)(圖4)。
 圖4
各組RGC存活率比較(n=6) RGC:視網膜神經節細胞;ET:依托咪酯;ET低劑量組:劃傷+1 μmol/L ET;ET中劑量組:劃傷+5 μmol/L ET;ET高劑量組:劃傷+10μmol/L ET。*與RGC劃傷組比較,P<0.05;#與ET低劑量組比較,P<0.05
圖4
各組RGC存活率比較(n=6) RGC:視網膜神經節細胞;ET:依托咪酯;ET低劑量組:劃傷+1 μmol/L ET;ET中劑量組:劃傷+5 μmol/L ET;ET高劑量組:劃傷+10μmol/L ET。*與RGC劃傷組比較,P<0.05;#與ET低劑量組比較,P<0.05
流式細胞儀檢測結果顯示,建模后7 d,對照組、RGC劃傷組、ET低劑量組、ET中劑量組、ET高劑量組RGC凋亡率分別為(5.08±0.17)%、(18.67±1.24)%、(17.96±0.74)%、(15.11±0.56)%、(11.67±1.32)%;RGC劃傷組、ET低劑量組、ET中劑量組、ET高劑量組RGC凋亡率較對照組顯著增高,差異有統計學意義(F=132.371,P<0.001)。組間兩兩比較,RGC劃傷組凋亡率較對照組顯著升高,差異有統計學意義(P<0.001);與RGC劃傷組比較,ET低劑量組與之差異無統計學意義(P=0.869),ET中劑量組、ET高劑量組RGC凋亡率顯著降低,差異均有統計學意義(P<0.05);與ET中劑量組比較,ET高劑量組RGC凋亡率進一步降低,差異有統計學意義(P=0.007)(圖5)。
 圖5
各組RGC凋亡率比較(n=3) RGC:視網膜神經節細胞;ET:依托咪酯;ET低劑量組:劃傷+1 μmol/L ET;ET中劑量組:劃傷+5 μmol/L ET;ET高劑量組:劃傷+10μmol/L ET。*與對照組比較,P<0.05;#與RGC劃傷組比較,P<0.05;△與ET中劑量組比較,P<0.05
圖5
各組RGC凋亡率比較(n=3) RGC:視網膜神經節細胞;ET:依托咪酯;ET低劑量組:劃傷+1 μmol/L ET;ET中劑量組:劃傷+5 μmol/L ET;ET高劑量組:劃傷+10μmol/L ET。*與對照組比較,P<0.05;#與RGC劃傷組比較,P<0.05;△與ET中劑量組比較,P<0.05
3 討論
本研究以神經元培養基原代培養出生后0~3 d的SD大鼠RGC。Thy1.1抗原是細胞表面的一種糖蛋白,表達于嚙齒類動物多種細胞,高表達于大鼠的腦和胸腺。視網膜內Thy1.1特異性表達于RGC,但體外培養時尚可發現Thy1.1染色陽性的成纖維細胞[11-12]。MAP2是成熟神經元的標記物,成纖維細胞不表達MAP2。因此,本研究采用Thy1.1和MAP2進行免疫熒光雙標染色對培養7 d的RGC進行鑒定。結果顯示,Thy1.1陽性細胞和MAP2陽性細胞高度一致,證明雙標細胞為原代培養的RGC。
倒置相差顯微鏡觀察發現,RGC原代培養24 h后即可長出突起,培養4 d時突起增長,少數細胞之間的突起相互連接;培養7 d時突起進一步增長,相互連接的突起也明顯增多,細胞融合度約80%。因此本研究選擇培養7 d時的細胞進行體外實驗。視神經由RGC的軸突構成,在體實驗中橫斷視神經是將RGC的軸突切斷,因此可通過機械性損傷體外培養的RGC來模擬在體視神經損傷。已有多項研究采用機械性劃傷培養神經元的突起而成功構建體外神經損傷模型[13-15]。本研究按照Wang等[15]方法采用虹膜刀劃傷RGC的突起模擬視神經損傷。ET的臨床使用濃度為1~10 μmol/L[16],為觀察不同濃度ET對損傷RGC的作用,本研究分別選取1、5、10 μmol/L作為低、中、高劑量進行實驗。參照ET的在體實驗,體外實驗中我們選擇劃傷RGC后7 d作為觀察時間點。
本研究結果顯示,劃傷RGC后,劃痕邊緣及附近區域可見較多成群分布的死亡細胞碎片。劃傷后給予中、高劑量ET處理,可減少死亡細胞碎片群的數量。CCK-8增生分析法結果顯示,低劑量ET未能提高細胞存活率,而中、高劑量ET可顯著提高細胞存活率;與中劑量ET作用比較,高劑量ET作用下細胞存活率更高,差異有統計學意義,呈現出量效關系。正常培養RGC過程中有少量細胞發生凋亡。Annexin Ⅴ/PI雙染色結果顯示,與對照組比較,建模后7 d,RGC劃傷組細胞凋亡率顯著增高,不同劑量ET干預后,低劑量ET未能減少細胞凋亡率,而中、高劑量ET可顯著降低細胞凋亡率。與中劑量ET作用比較,高劑量ET降低細胞凋亡率的作用更為顯著并呈量效關系。因此,低劑量ET對損傷RGC缺乏神經保護作用,而5、10 μmol/L的ET對劃傷的RGC具有呈量效關系的神經保護作用。
本研究結果表明,ET對體外機械性損傷的RGC具有神經保護作用,但具體作用機制我們未能進行探索。結合我們前期體內實驗發現的結論,即抗氧化應激參與了ET的神經保護作用[6],今后我們將針對ET的體外神經保護作用與抗氧化應激的關系進行深入探討。