引用本文: 焦陽, 韓銀萍, 鄧莉, 柯洪敏, 蔣澍, 蔡莉. 纖維化纖維微細菌眼內炎1例. 中華眼底病雜志, 2023, 39(6): 496-498. doi: 10.3760/cma.j.cn511434-20220228-00108 復制
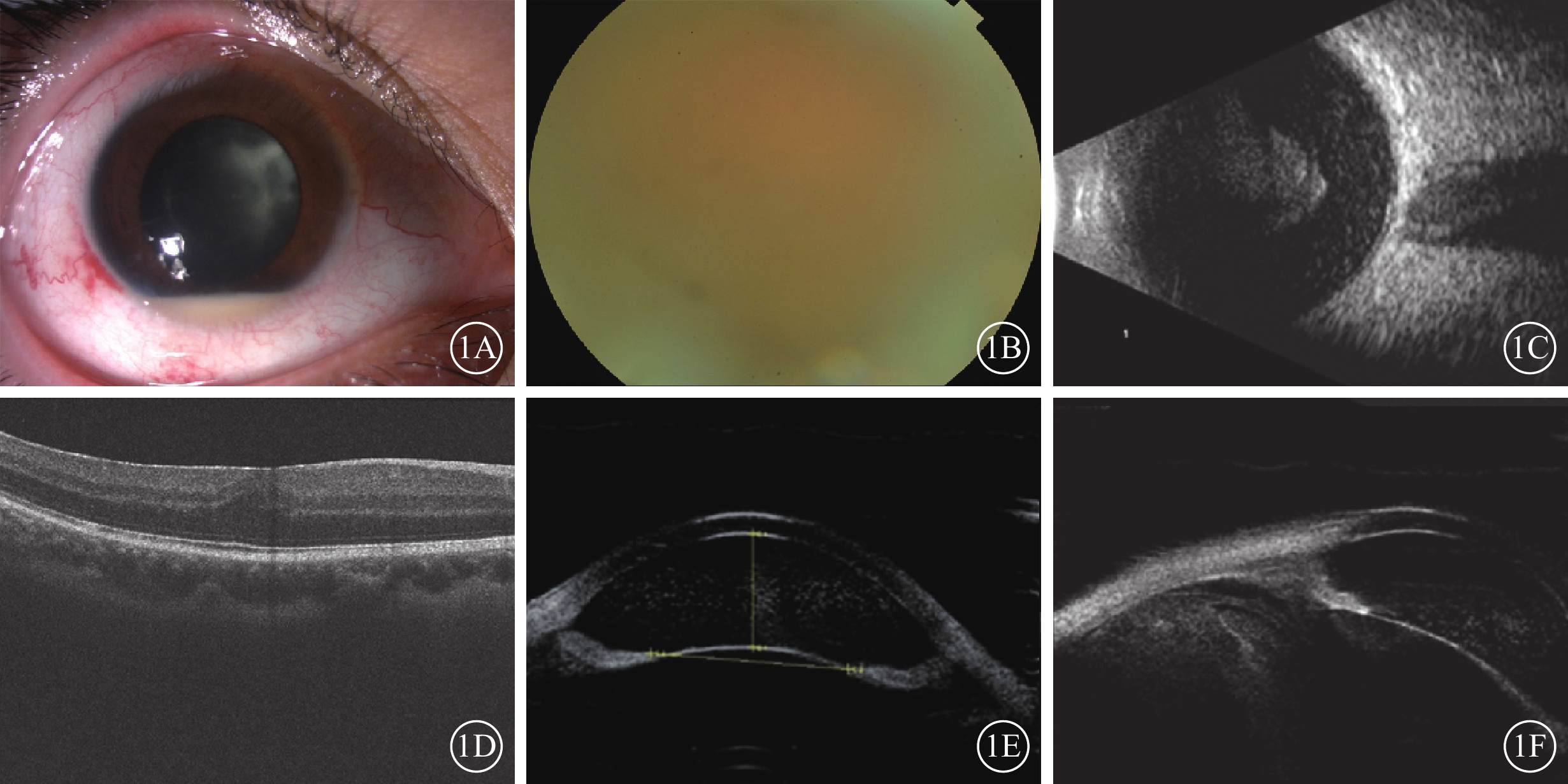
患者女,22歲。因右眼反復眼紅、視力下降伴前房積膿7個月于2021年5月26日到深圳大學總醫院眼科就診。患者既往健康,否認手術史。患者曾于外院診斷為“右眼全葡萄膜炎”,并給予局部和全身糖皮質激素(以下簡稱為激素)治療后好轉,但反復發作,間隔時間逐漸縮短。眼部檢查:患者右眼視力手動,矯正不能提高;左眼視力0.25,最佳矯正視力(BCVA)1.0。右眼、左眼眼壓分別為11、14 mm Hg(1 mm Hg=0.133 kPa)。左眼眼前節及眼底未見異常。右眼結膜混合性充血(++),角膜后塵狀沉著物(++),房水閃輝(++~+++),細胞(++~+++),前房2 mm積膿,晶狀體后灰白色顆粒狀混濁;玻璃體顆粒狀、絮狀混濁(圖1A),細胞(+++);眼底窺不清(圖1B)。B型超聲檢查,右眼玻璃體混濁(圖1C)。光相干斷層掃描檢查,右眼黃斑區神經上皮層增厚,表面強信號條帶(圖1D)。超聲生物顯微鏡(UBM)檢查,前房大量點狀中回聲,玻璃體混濁(圖1E,1F)。抽血送檢人類白細胞抗原(HLA)-B51(+)。診斷:右眼全葡萄膜炎?右眼眼內炎?雙眼屈光不正。
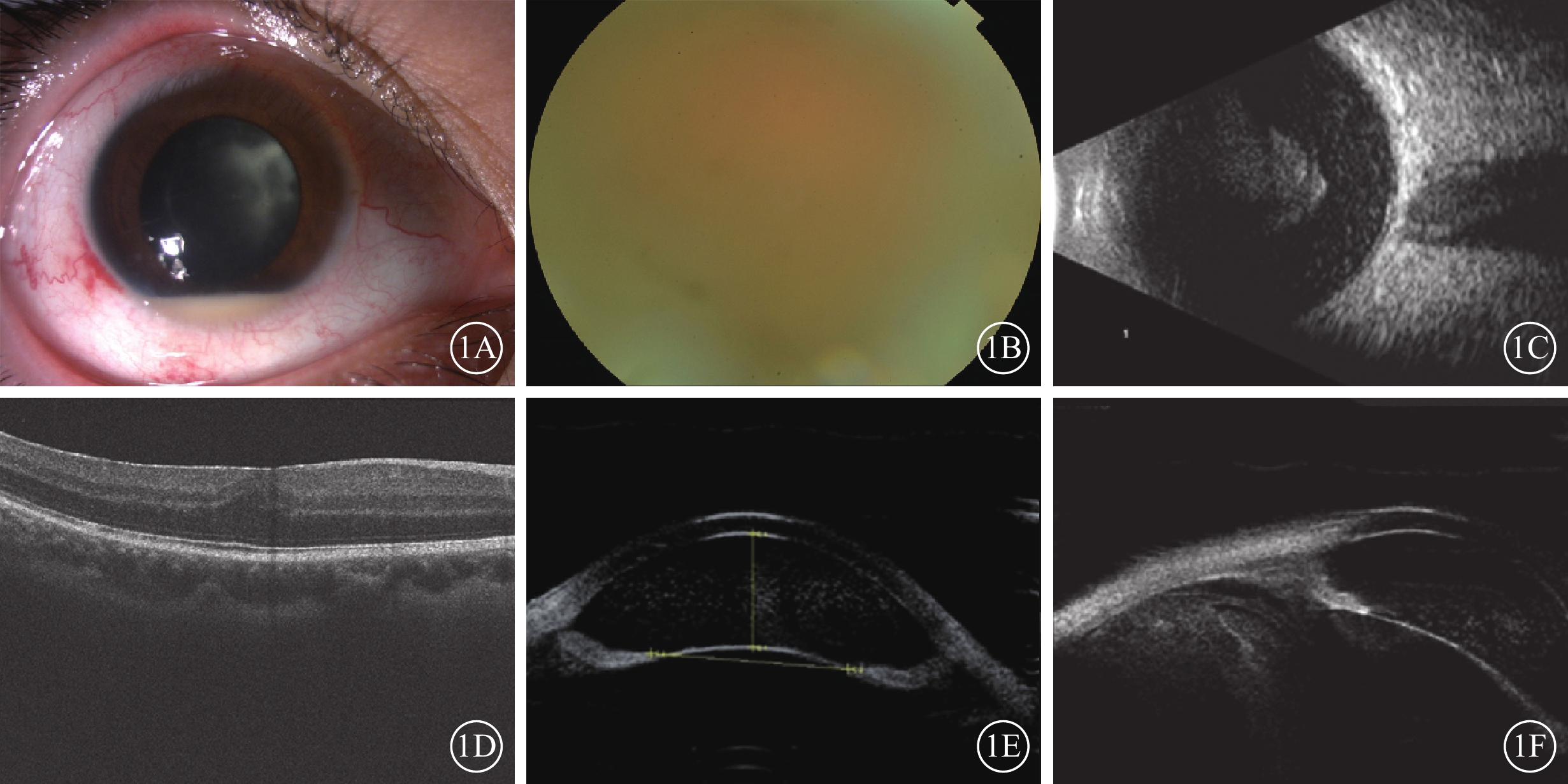 圖1
纖維化纖維微細菌眼內炎患者初診時右眼眼部檢查像 1A示散瞳下眼前節像,前房積膿,晶狀體后混濁;1B示彩色眼底像,視網膜不清;1C示B型超聲像,玻璃體混濁;1D示光相干斷層掃描像,黃斑區神經上皮層增厚,表面強信號條帶;1E、1F示超聲生物顯微鏡像,前房大量點狀中回聲,前段玻璃體混濁
圖1
纖維化纖維微細菌眼內炎患者初診時右眼眼部檢查像 1A示散瞳下眼前節像,前房積膿,晶狀體后混濁;1B示彩色眼底像,視網膜不清;1C示B型超聲像,玻璃體混濁;1D示光相干斷層掃描像,黃斑區神經上皮層增厚,表面強信號條帶;1E、1F示超聲生物顯微鏡像,前房大量點狀中回聲,前段玻璃體混濁
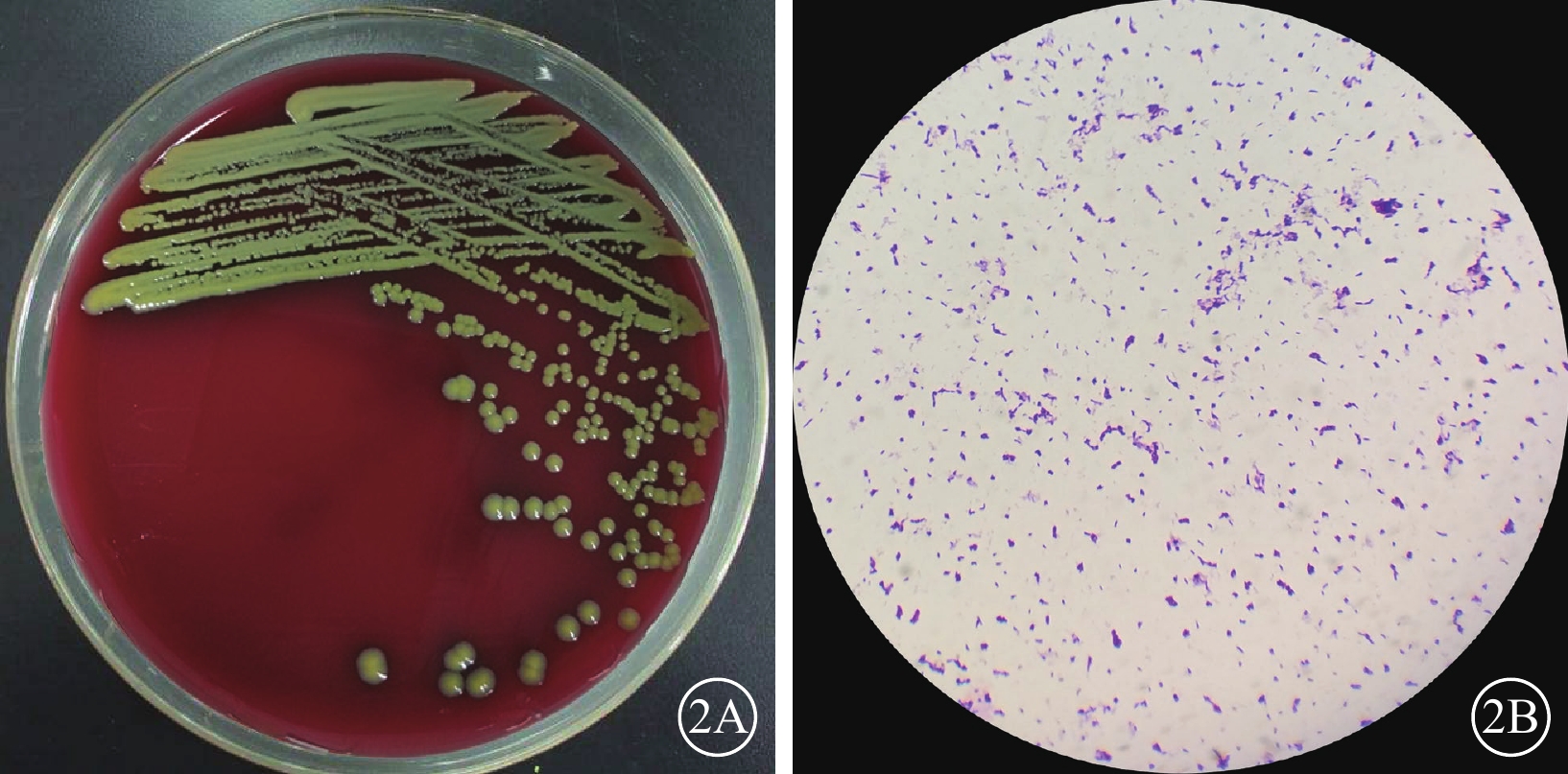
為明確診斷,患者于次日接受了右眼診斷性玻璃體切割手術(PPV)。手術中切取玻璃體液0.5 ml送檢。細菌培養結果為纖維化纖維微細菌(cellulosimicrobium cellulans)(圖2A),病原微生物宏基因組檢測驗證得到革蘭氏陽性菌總序列數為8 762。最終診斷:右眼眼內炎。停用全身激素。使用KB法進行藥物敏感試驗,但由于缺少臨床和實驗室標準協會的指南,無法確認藥物敏感性。考慮到萬古霉素的大抑菌環,給予玻璃體腔注射10 mg/ml的萬古霉素0.1 ml、1.6 mg/ml的莫西沙星0.125 ml,共2次,并聯合全身萬古霉素(0.5 g,1次/12 h,靜脈滴注3 d)治療。治療后患者癥狀明顯好轉,BCVA 0.2。將治療方案改為局部抗生素+激素滴眼液點眼,口服莫西沙星出院。3周后,患者右眼視力下降至數指/10 cm,出現前房積膿。給予之前相同的方案進行玻璃體腔注射抗生素治療,患者癥狀體征均無明顯改善,遂行右眼PPV,并給予玻璃體腔注射萬古霉素治療。手術中可見患眼玻璃體白色絮狀混濁,細胞(+++),視盤鼻側見白色小片類圓形病灶。手術后首日,患者BCVA恢復至0.3。后續接受了3次玻璃體腔注藥(10 mg/ml的萬古霉素0.1 ml、1.6 mg/ml的莫西沙星0.125 ml),患者病情穩定,出院口服頭孢呋辛治療。
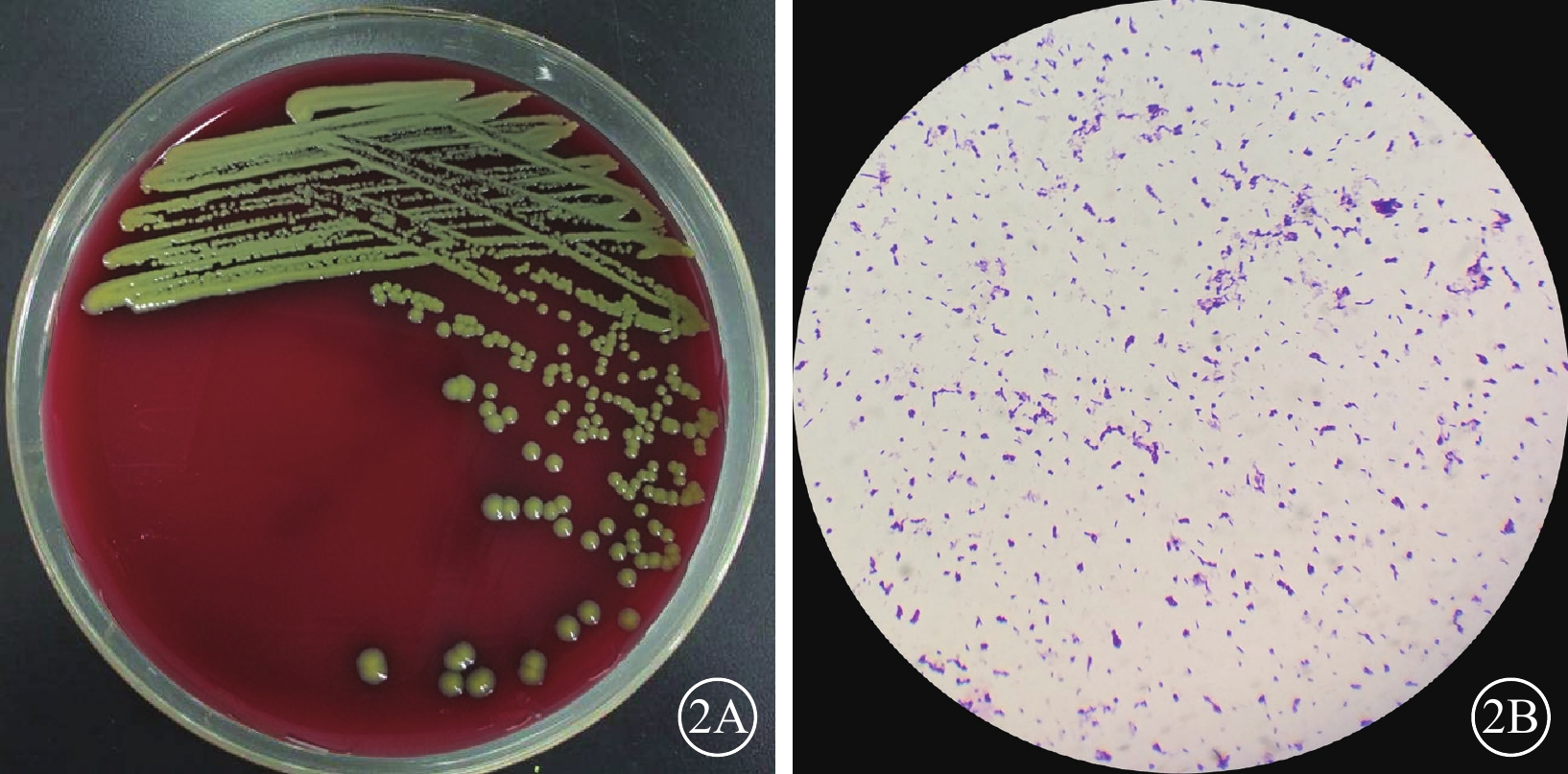 圖2
纖維化纖維微細菌眼內炎患者玻璃體液細菌培養結果 2A示培養24 h,菌落呈黃色;2B示革蘭染色像,呈革蘭染色陽性桿狀
圖2
纖維化纖維微細菌眼內炎患者玻璃體液細菌培養結果 2A示培養24 h,菌落呈黃色;2B示革蘭染色像,呈革蘭染色陽性桿狀
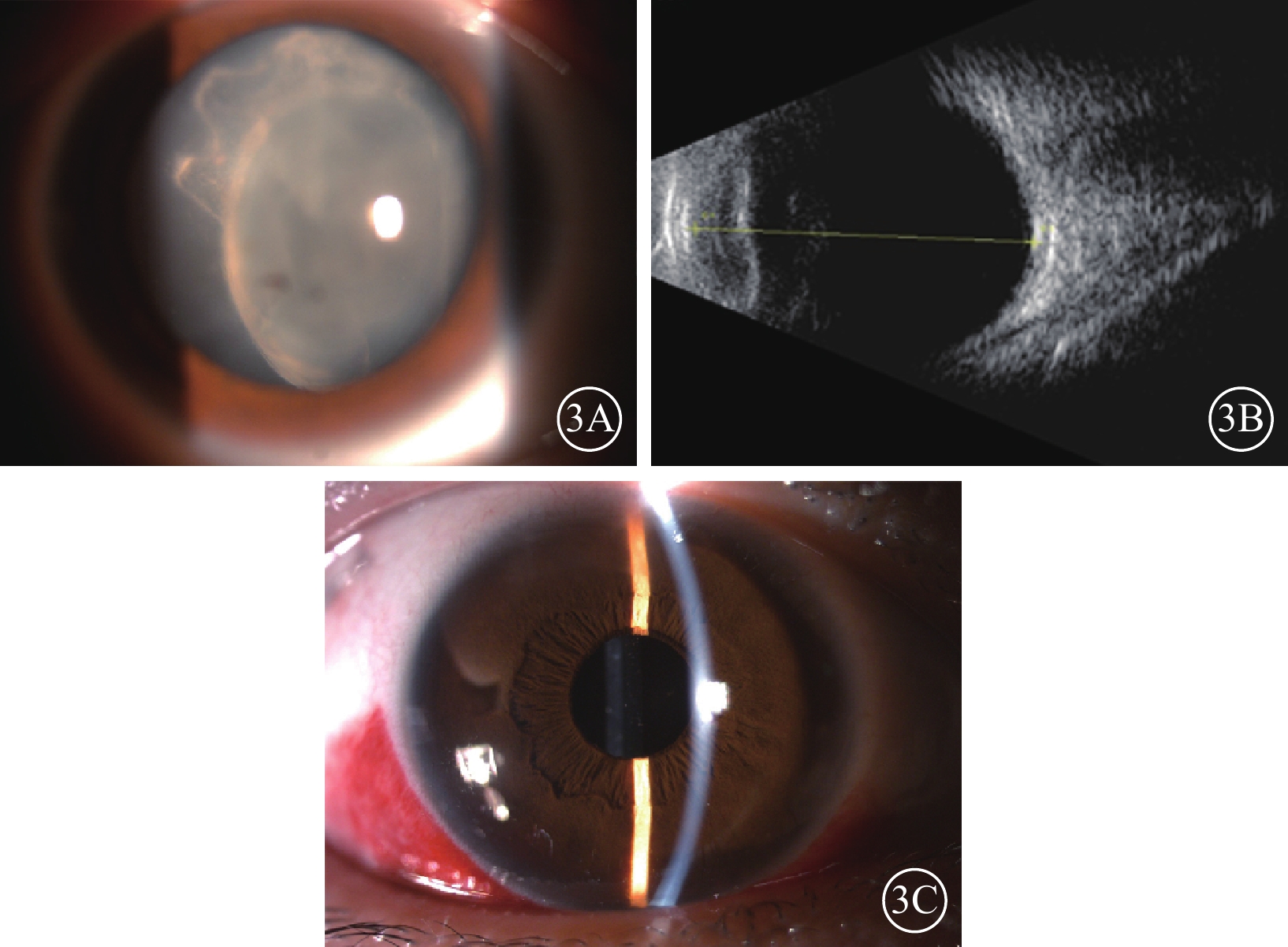
1個月后患者右眼視力再次下降至數指/10 cm,晶狀體呈灰白色混濁,后囊膜破裂(圖3A),眼底窺不入。B型超聲檢查,右眼玻璃體輕度混濁(圖3B);UBM檢查未見異常。給予患者右眼晶狀體切除、玻璃體腔注藥治療(10 mg/ml的萬古霉素0.1 ml、20 mg/ml頭孢他啶0.1 ml)。手術中見晶狀體皮質破碎散落在視網膜前,前囊膜完整。玻璃體細胞(++),后極部視網膜水腫。手術后繼續予以全身抗感染治療1周,眼前后節均未觀察到活動性炎癥,BCVA達到0.9。4個月后炎癥依然穩定,患者接受了人工晶狀體睫狀溝植入手術。手術后眼前后節無異常,因前囊膜輕度混濁(圖3C),BCVA穩定在0.7。
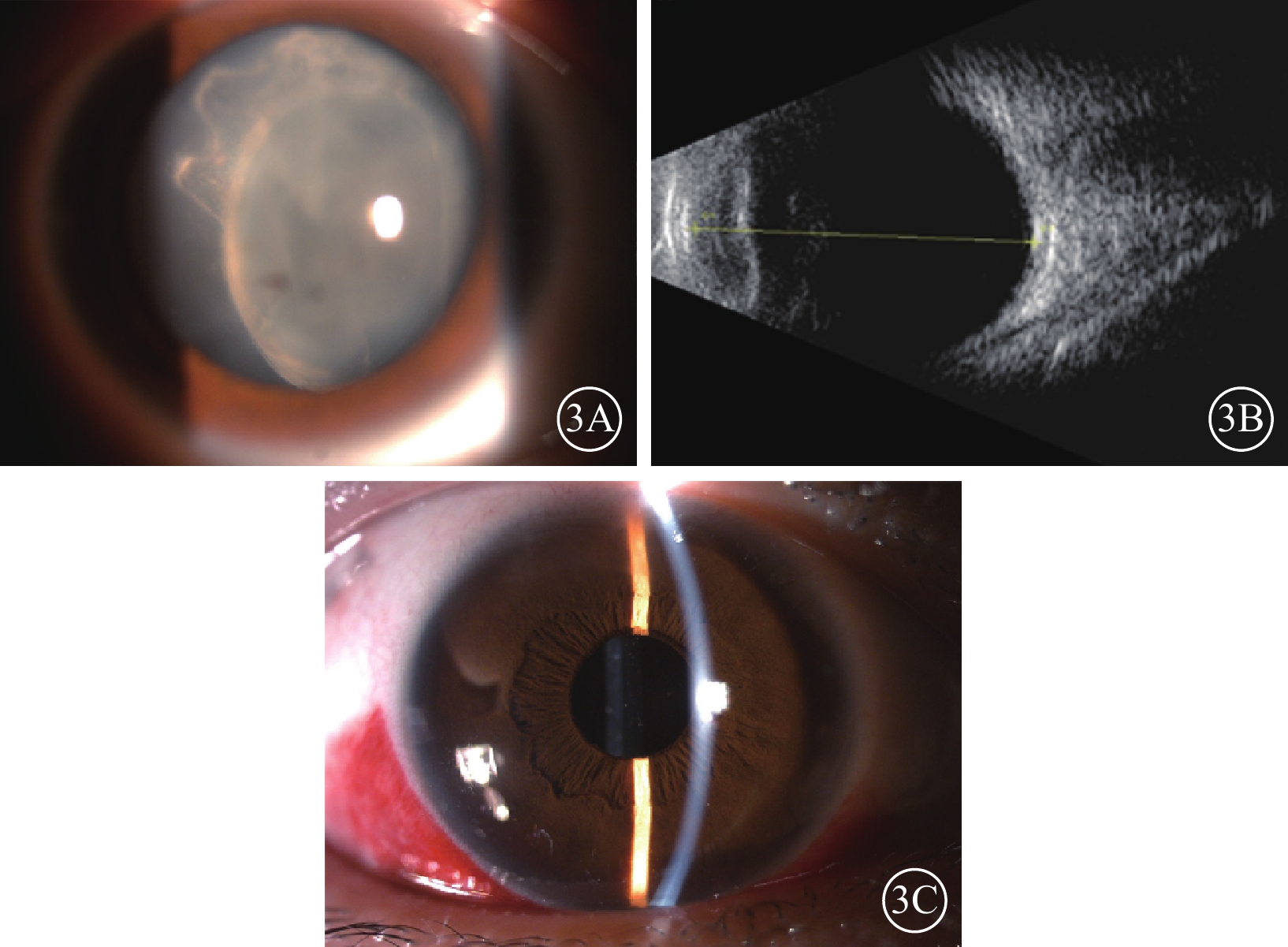 圖3
纖維化纖維微細菌眼內炎患者晶狀體切除手術前后右眼眼部檢查像 3A示手術前散瞳下眼前節像,晶狀體不均勻混濁,后囊膜不完整;3B示手術前B型超聲像,玻璃體輕度混濁;3C示手術后眼前節像,人工晶狀體位正,前囊膜輕度混濁
圖3
纖維化纖維微細菌眼內炎患者晶狀體切除手術前后右眼眼部檢查像 3A示手術前散瞳下眼前節像,晶狀體不均勻混濁,后囊膜不完整;3B示手術前B型超聲像,玻璃體輕度混濁;3C示手術后眼前節像,人工晶狀體位正,前囊膜輕度混濁
討論 纖維化纖維微細菌,舊稱溶黃嘌呤厄菌,是一種革蘭陽性棒狀桿菌,屬于放線菌目,為需氧兼性厭氧菌,廣泛存在于土壤、海綿等常溫環境中,在溫泉和南極雪層等極端環境也有被發現的案例[1]。Sharma等[2]對該菌行基因組分析后標注了13個致病島,它們總共可以編碼Fic和VbhA毒素-抗毒素系統等49個潛在的致人感染的毒力因子。該菌可導致馬的流產或早產[3],但對人體的感染較為罕見,通常見于免疫缺陷者或異物攜帶者。目前已報道病例包括腹膜炎、腱膜炎、腦膜炎、心內膜炎、外傷性關節炎、舌潰瘍、新生兒敗血癥、足菌腫等[4-13],其中最常見的是心內導管植入手術后的感染性心內膜炎。該菌通常對大環內酯類耐藥,對萬古霉素、利福平、復方磺胺甲惡唑、利奈唑胺敏感。關于該菌眼內炎的報道較為罕見,Hussain等[14]于1987年報道了1例金屬異物外傷后該菌所致的眼內炎,為首次報道該菌引起的眼內炎。Jaru-Ampornpan等[15]于2011年報道了1例金屬異物外傷后該菌所致眼內炎,患者經玻璃體腔注射萬古霉素、頭孢他啶、莫西沙星以及3次PPV取出異物后病情穩定,視力提高至20/70。Akcakaya等[16]對8例內眼手術后眼內炎患者的眼內液進行培養,其中3例確認為纖維化纖維微細菌感染,經玻璃體腔注射頭孢他啶、萬古霉素、地塞米松治療,其中1例接受了PPV,治療后患者視力均穩定在5/10以上。
本例患者表現為炎癥反復發作,伴前房積膿,激素治療有效,且HLA-B51(+),極易被誤診為白塞氏病,但通過病史分析和體格檢查高度懷疑眼內炎,經眼內液病原學檢查后確診。患者為眼部癥狀,無反復口腔潰瘍、皮損及生殖器潰瘍,無關節炎、消化系統癥狀、血管病變、中樞神經系統病變等。在我科就診時,行多次有創操作并停用激素,改為抗感染治療,癥狀未加重而是明顯好轉,提示其在我科就診期間為眼內炎。我們分析有兩種可能:(1)患者HLA-B51(+),為白塞氏病易感人群。患者因不知名原因感染纖維化纖維微細菌,表現出與葡萄膜炎相似的眼內炎癥狀;(2)患者可能既往為白塞氏病不完全型患者,經既往外院抗炎治療后白塞氏病得到控制,但在眼內注藥過程中造成了纖維化纖維微細菌的醫源性感染,因此患者發作時間逐漸縮短。該菌毒力較弱,但遷延不愈,患者口服和靜脈輸注抗生素治療對病情無明顯改善,初期玻璃體腔注藥取得了一定的效果,而對該疾病的治愈依賴于手術完全清除感染灶。第一次手術為診斷性PPV,未充分清除病灶。第二次手術考慮到患者為年輕女性,采取了保留晶狀體的PPV,同時為保護晶狀體,玻璃體清除不夠徹底。后期晶狀體后病灶加重,侵襲了晶狀體后囊,導致了后囊膜破裂,形成白內障。因此,對于纖維化纖維微細菌引起的眼內炎,手術清除全部病灶,聯合敏感抗生素治療至關重要。
患者女,22歲。因右眼反復眼紅、視力下降伴前房積膿7個月于2021年5月26日到深圳大學總醫院眼科就診。患者既往健康,否認手術史。患者曾于外院診斷為“右眼全葡萄膜炎”,并給予局部和全身糖皮質激素(以下簡稱為激素)治療后好轉,但反復發作,間隔時間逐漸縮短。眼部檢查:患者右眼視力手動,矯正不能提高;左眼視力0.25,最佳矯正視力(BCVA)1.0。右眼、左眼眼壓分別為11、14 mm Hg(1 mm Hg=0.133 kPa)。左眼眼前節及眼底未見異常。右眼結膜混合性充血(++),角膜后塵狀沉著物(++),房水閃輝(++~+++),細胞(++~+++),前房2 mm積膿,晶狀體后灰白色顆粒狀混濁;玻璃體顆粒狀、絮狀混濁(圖1A),細胞(+++);眼底窺不清(圖1B)。B型超聲檢查,右眼玻璃體混濁(圖1C)。光相干斷層掃描檢查,右眼黃斑區神經上皮層增厚,表面強信號條帶(圖1D)。超聲生物顯微鏡(UBM)檢查,前房大量點狀中回聲,玻璃體混濁(圖1E,1F)。抽血送檢人類白細胞抗原(HLA)-B51(+)。診斷:右眼全葡萄膜炎?右眼眼內炎?雙眼屈光不正。
 圖1
纖維化纖維微細菌眼內炎患者初診時右眼眼部檢查像 1A示散瞳下眼前節像,前房積膿,晶狀體后混濁;1B示彩色眼底像,視網膜不清;1C示B型超聲像,玻璃體混濁;1D示光相干斷層掃描像,黃斑區神經上皮層增厚,表面強信號條帶;1E、1F示超聲生物顯微鏡像,前房大量點狀中回聲,前段玻璃體混濁
圖1
纖維化纖維微細菌眼內炎患者初診時右眼眼部檢查像 1A示散瞳下眼前節像,前房積膿,晶狀體后混濁;1B示彩色眼底像,視網膜不清;1C示B型超聲像,玻璃體混濁;1D示光相干斷層掃描像,黃斑區神經上皮層增厚,表面強信號條帶;1E、1F示超聲生物顯微鏡像,前房大量點狀中回聲,前段玻璃體混濁
為明確診斷,患者于次日接受了右眼診斷性玻璃體切割手術(PPV)。手術中切取玻璃體液0.5 ml送檢。細菌培養結果為纖維化纖維微細菌(cellulosimicrobium cellulans)(圖2A),病原微生物宏基因組檢測驗證得到革蘭氏陽性菌總序列數為8 762。最終診斷:右眼眼內炎。停用全身激素。使用KB法進行藥物敏感試驗,但由于缺少臨床和實驗室標準協會的指南,無法確認藥物敏感性。考慮到萬古霉素的大抑菌環,給予玻璃體腔注射10 mg/ml的萬古霉素0.1 ml、1.6 mg/ml的莫西沙星0.125 ml,共2次,并聯合全身萬古霉素(0.5 g,1次/12 h,靜脈滴注3 d)治療。治療后患者癥狀明顯好轉,BCVA 0.2。將治療方案改為局部抗生素+激素滴眼液點眼,口服莫西沙星出院。3周后,患者右眼視力下降至數指/10 cm,出現前房積膿。給予之前相同的方案進行玻璃體腔注射抗生素治療,患者癥狀體征均無明顯改善,遂行右眼PPV,并給予玻璃體腔注射萬古霉素治療。手術中可見患眼玻璃體白色絮狀混濁,細胞(+++),視盤鼻側見白色小片類圓形病灶。手術后首日,患者BCVA恢復至0.3。后續接受了3次玻璃體腔注藥(10 mg/ml的萬古霉素0.1 ml、1.6 mg/ml的莫西沙星0.125 ml),患者病情穩定,出院口服頭孢呋辛治療。
 圖2
纖維化纖維微細菌眼內炎患者玻璃體液細菌培養結果 2A示培養24 h,菌落呈黃色;2B示革蘭染色像,呈革蘭染色陽性桿狀
圖2
纖維化纖維微細菌眼內炎患者玻璃體液細菌培養結果 2A示培養24 h,菌落呈黃色;2B示革蘭染色像,呈革蘭染色陽性桿狀
1個月后患者右眼視力再次下降至數指/10 cm,晶狀體呈灰白色混濁,后囊膜破裂(圖3A),眼底窺不入。B型超聲檢查,右眼玻璃體輕度混濁(圖3B);UBM檢查未見異常。給予患者右眼晶狀體切除、玻璃體腔注藥治療(10 mg/ml的萬古霉素0.1 ml、20 mg/ml頭孢他啶0.1 ml)。手術中見晶狀體皮質破碎散落在視網膜前,前囊膜完整。玻璃體細胞(++),后極部視網膜水腫。手術后繼續予以全身抗感染治療1周,眼前后節均未觀察到活動性炎癥,BCVA達到0.9。4個月后炎癥依然穩定,患者接受了人工晶狀體睫狀溝植入手術。手術后眼前后節無異常,因前囊膜輕度混濁(圖3C),BCVA穩定在0.7。
 圖3
纖維化纖維微細菌眼內炎患者晶狀體切除手術前后右眼眼部檢查像 3A示手術前散瞳下眼前節像,晶狀體不均勻混濁,后囊膜不完整;3B示手術前B型超聲像,玻璃體輕度混濁;3C示手術后眼前節像,人工晶狀體位正,前囊膜輕度混濁
圖3
纖維化纖維微細菌眼內炎患者晶狀體切除手術前后右眼眼部檢查像 3A示手術前散瞳下眼前節像,晶狀體不均勻混濁,后囊膜不完整;3B示手術前B型超聲像,玻璃體輕度混濁;3C示手術后眼前節像,人工晶狀體位正,前囊膜輕度混濁
討論 纖維化纖維微細菌,舊稱溶黃嘌呤厄菌,是一種革蘭陽性棒狀桿菌,屬于放線菌目,為需氧兼性厭氧菌,廣泛存在于土壤、海綿等常溫環境中,在溫泉和南極雪層等極端環境也有被發現的案例[1]。Sharma等[2]對該菌行基因組分析后標注了13個致病島,它們總共可以編碼Fic和VbhA毒素-抗毒素系統等49個潛在的致人感染的毒力因子。該菌可導致馬的流產或早產[3],但對人體的感染較為罕見,通常見于免疫缺陷者或異物攜帶者。目前已報道病例包括腹膜炎、腱膜炎、腦膜炎、心內膜炎、外傷性關節炎、舌潰瘍、新生兒敗血癥、足菌腫等[4-13],其中最常見的是心內導管植入手術后的感染性心內膜炎。該菌通常對大環內酯類耐藥,對萬古霉素、利福平、復方磺胺甲惡唑、利奈唑胺敏感。關于該菌眼內炎的報道較為罕見,Hussain等[14]于1987年報道了1例金屬異物外傷后該菌所致的眼內炎,為首次報道該菌引起的眼內炎。Jaru-Ampornpan等[15]于2011年報道了1例金屬異物外傷后該菌所致眼內炎,患者經玻璃體腔注射萬古霉素、頭孢他啶、莫西沙星以及3次PPV取出異物后病情穩定,視力提高至20/70。Akcakaya等[16]對8例內眼手術后眼內炎患者的眼內液進行培養,其中3例確認為纖維化纖維微細菌感染,經玻璃體腔注射頭孢他啶、萬古霉素、地塞米松治療,其中1例接受了PPV,治療后患者視力均穩定在5/10以上。
本例患者表現為炎癥反復發作,伴前房積膿,激素治療有效,且HLA-B51(+),極易被誤診為白塞氏病,但通過病史分析和體格檢查高度懷疑眼內炎,經眼內液病原學檢查后確診。患者為眼部癥狀,無反復口腔潰瘍、皮損及生殖器潰瘍,無關節炎、消化系統癥狀、血管病變、中樞神經系統病變等。在我科就診時,行多次有創操作并停用激素,改為抗感染治療,癥狀未加重而是明顯好轉,提示其在我科就診期間為眼內炎。我們分析有兩種可能:(1)患者HLA-B51(+),為白塞氏病易感人群。患者因不知名原因感染纖維化纖維微細菌,表現出與葡萄膜炎相似的眼內炎癥狀;(2)患者可能既往為白塞氏病不完全型患者,經既往外院抗炎治療后白塞氏病得到控制,但在眼內注藥過程中造成了纖維化纖維微細菌的醫源性感染,因此患者發作時間逐漸縮短。該菌毒力較弱,但遷延不愈,患者口服和靜脈輸注抗生素治療對病情無明顯改善,初期玻璃體腔注藥取得了一定的效果,而對該疾病的治愈依賴于手術完全清除感染灶。第一次手術為診斷性PPV,未充分清除病灶。第二次手術考慮到患者為年輕女性,采取了保留晶狀體的PPV,同時為保護晶狀體,玻璃體清除不夠徹底。后期晶狀體后病灶加重,侵襲了晶狀體后囊,導致了后囊膜破裂,形成白內障。因此,對于纖維化纖維微細菌引起的眼內炎,手術清除全部病灶,聯合敏感抗生素治療至關重要。