引用本文: 李杰, 郭曉紅, 邢亞斯, 路小楠, 戴淑真. YAP1基因新發致病性變異致孤立性眼組織缺損一家系. 中華眼底病雜志, 2023, 39(7): 544-548. doi: 10.3760/cma.j.cn511434-20220818-00459 復制
眼組織缺損(MAC)屬于先天性發育性眼部異常中的一種,即胚胎發育早期視裂閉合不全引起的眼發育調控紊亂,主要特征包括無眼征、小眼征以及MAC[1]。遺傳類型上可為家族性或散發性,且具有顯著的遺傳異質性,致病基因包括PAX6、SOX2、OTX2、BMP4、BMP7、STRA6等[2]。2014年,Williamson等[3]首次鑒定出常染色體顯性遺傳新致病基因YAP1,除眼組織的缺損征,部分患者表現出不同的眼外特征,包括聽力損失、智力缺損、血尿和唇腭裂。我們在一個孤立性MAC家系中發現YAP1基因的缺失變異。現將結果報道如下。
1 對象和方法
本研究通過河南省立眼科醫院的機構審查委員會審核[批準號:HNEECKY-2017(6)]; 遵循《赫爾辛基宣言》原則;所有受檢者和未成年患者監護人均獲知情并簽署書面知情同意書。
2019年5月至2022年5月于河南省立眼科醫院遺傳眼病門診就診的MAC一家系1例患者(先證者)和3名家系成員(圖1)納入本研究。詳細詢問患者病史和家族史,并行最佳矯正視力(BCVA)、裂隙燈顯微鏡、超廣角眼底彩色照相、光相干斷層掃描(OCT)、B型超聲檢查以及眼軸長度(AL)測量。
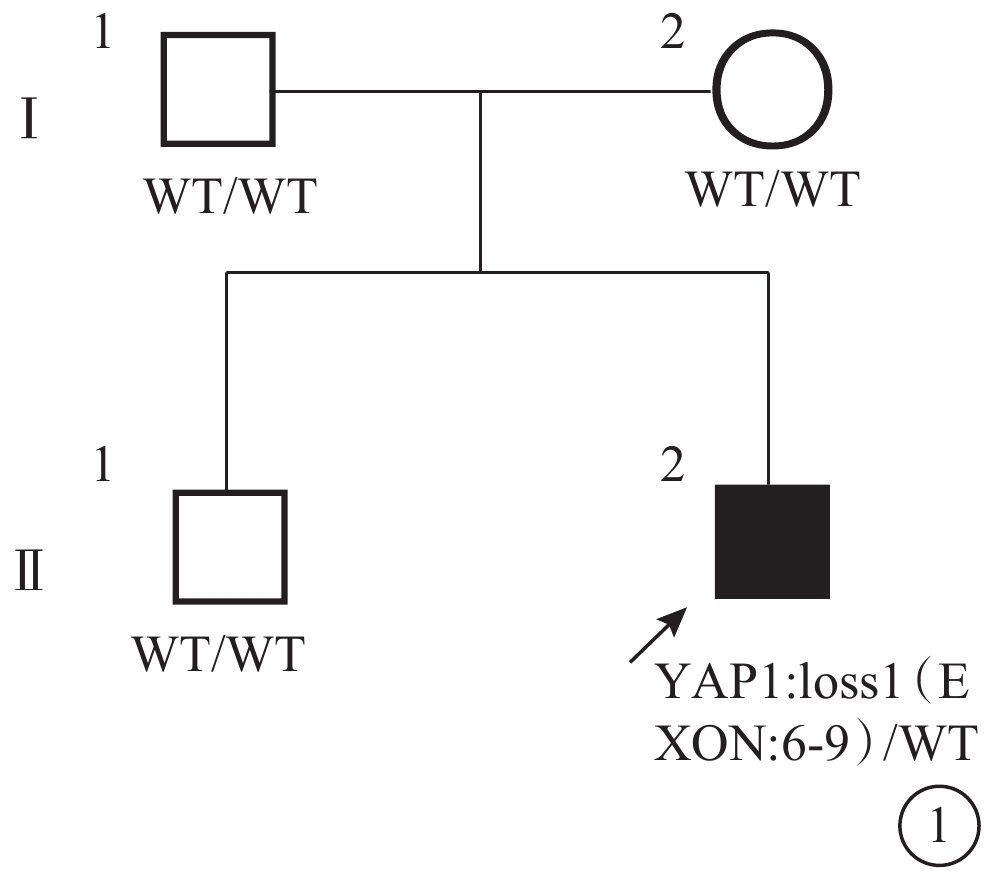
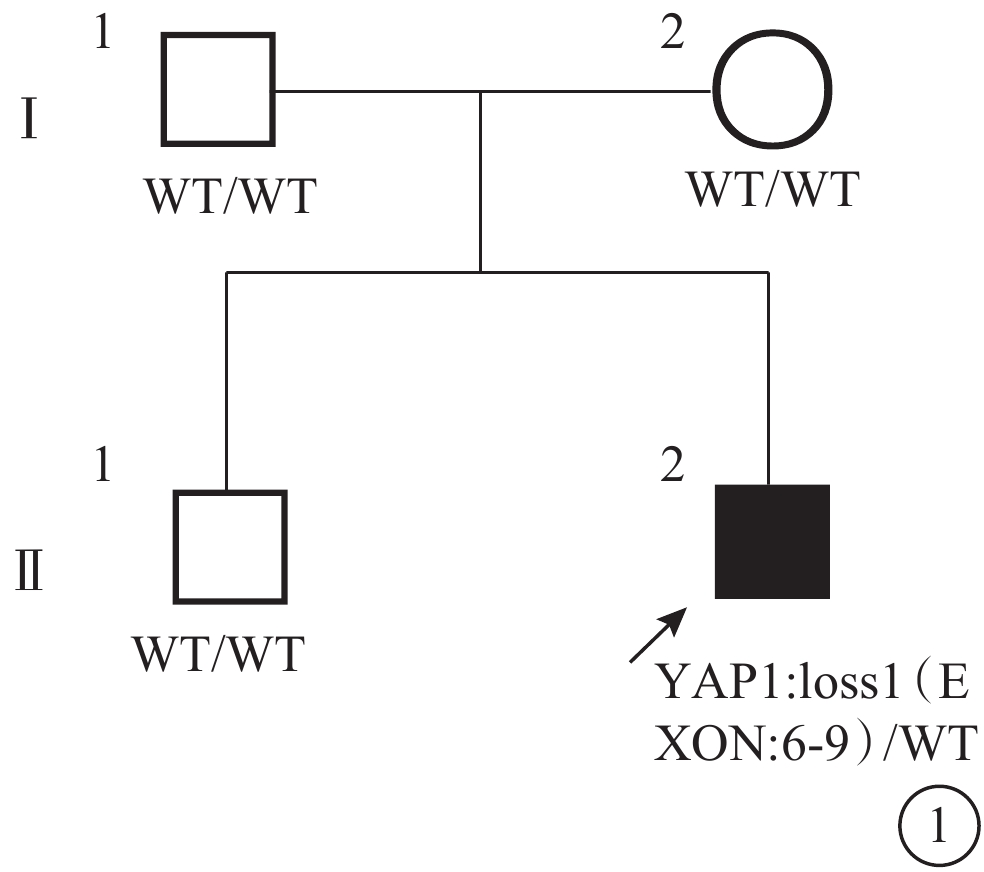 圖1
眼組織缺損家系圖 ↗:先證者;□:正常男性;○:正常女性;WT:野生型
圖1
眼組織缺損家系圖 ↗:先證者;□:正常男性;○:正常女性;WT:野生型
提取基因組DNA。采集先證者及其父母、兄長外周靜脈血并分離白細胞,TIANamp Blood DNA Kit 試劑盒(北京Tiangen Biotech公司)按照操作規程提取全基因組DNA,Qubit? 2.0熒光定量儀(QubitTM雙鏈DNA檢測試劑盒,美國Invitrogen公司)和瓊脂糖凝膠電泳對基因組DNA質量和數量進行評估。
全外顯子組測序。采集先證者及其父母、兄長外周靜脈血3 ml行Trio全外顯子組測序,采用美國IDT公司xGen? Exome Research Panel v1.0試劑盒對DNA目標區域進行捕獲,建立DNA文庫;采用美國Illumina公司Illumina NovaSeq6000高通量測序儀對DNA樣本進行測序,目標序列測序覆蓋度不低于99%。測序過程由北京全譜醫學檢驗實驗室完成。應用Basecall分析軟件BclToFastq得到原始數據,采用fastp軟件對原始數據進行質控,去除接頭、低質量讀數等。采用Burrows-Wheeler Aligner比對軟件與參考序列GRCh37/hg19進行比對統計。使用GATK軟件分析出單核苷酸多態、插入缺失標記等,得到候選基因的全部變異。基于ClinVar(https://www.ncbi.nlm.nih.gov/clinvar/)、人類基因變異數據庫(HGMD,http://www.hgmd.cf.ac.uk/ac/index.php)、人群基因頻率數據庫(gnomAD,https://gnomad.broadinstitute.org/)、外顯子組測序項目(https://esp.gs.washington.edu/drupal/)、千人基因組計劃數據庫(http://www.1000genomes.org/)等公共數據庫和群體頻率數據庫對檢測變異進行生物信息學注釋,并根據數據庫的資料預測其致病或有害影響。采用匯集分子生物學注釋、生物學、遺傳學和臨床特征分析為一體的遺傳病精準診斷云平臺系統分析篩選(北京智因東方轉化醫學研究中心自行開發構建,https://www.chigene.org),結合正常人基因組數據庫、致病變異數據庫、已知四千種遺傳病臨床特征數據庫等及基因數據庫的并行分析算法,依據美國醫學遺傳學與基因組學學會(ACMG)2015年發布的《序列變異解讀標準和指南》對新發變異進行基因變異致病性評估[4]。
采用正常對照、先證者及其父母和兄長樣本,驗證YAP1基因6~9外顯子雜合缺失變異。采用兩步法熒光定量聚合酶鏈反應(PCR),上下游引物各0.25 μl(2.5 μmol/L),樣本DNA 0.5 μl(100 ng),以及SYBR Green Real time PCR Master Mix(SYBR Green熒光定量PCR反應試劑體系)5 μl。反應采用ABI Step One/Plus PCR儀檢測,每個試驗重復2次。以Ct值最低者為基準,計算正常對照和先證者的Ct差值,將先證者Ct值減去此差值。對正常對照樣本和調整后的先證者樣本的Ct值進行比較,若兩者差異超過1,則可能為缺失或重復。再對可能有重復或缺失的外顯子和內參基因同時做熒光定量(3個重復樣),基因組上目標基因拷貝數檢測的內參基因為人血清白蛋白基因ALB。最后用正常對照樣本做可能有重復或缺失的外顯子和內參基因的正常對照濃度梯度的熒光定量標準曲線,得出相應外顯子和內參基因的擴增效率。根據pfaffl計算公式計算得出目標外顯子和內參基因基因組拷貝數的比值。
2 結果
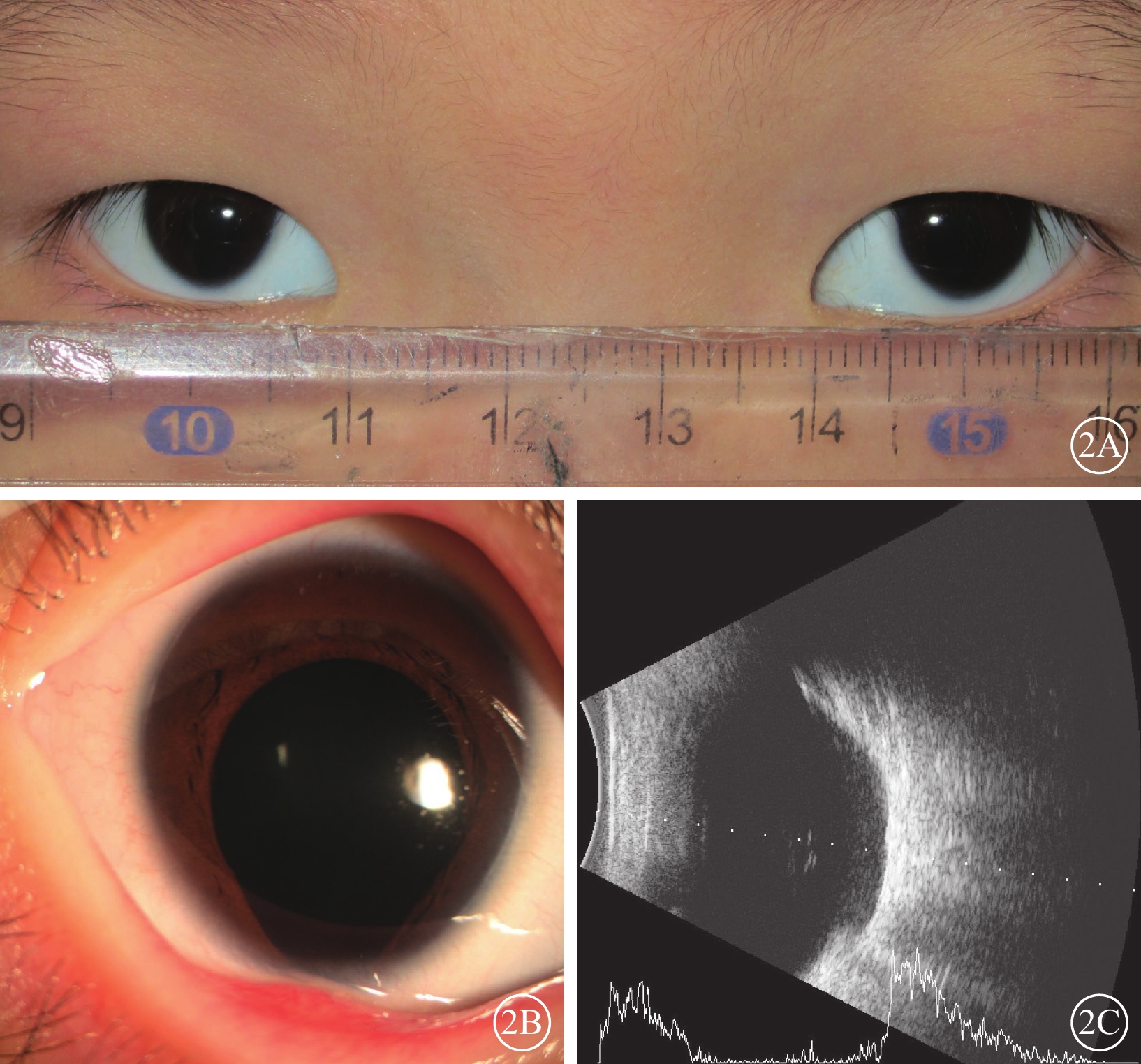
先證者(Ⅱ2)男,首次就診時3歲。監護人述患兒自幼雙眼視力差,眼球震顫。3歲首次就診時屈光度:右眼-4.00 DS/-0.50 DC×105°,左眼-3.50 DS/-1.25 DC×80°;6歲時屈光度及BCVA:右眼-6.50 DS/-2.00 DC×110°→0.05,左眼-6.00 DS/-1.50 DC×80°→0.2。AL:4歲10個月,右眼、左眼分別為24.62、23.92 mm;5歲7個月,右眼、左眼分別為25.24、24.36 mm。雙眼眼球水平鐘擺樣震顫;豎橢圓形小角膜(水平直徑約8.0 mm)(圖2A);虹膜下方缺損,呈“鎖孔”狀(圖2B)。B型超聲檢查,雙眼眼球組織缺損(圖2C)。超廣角眼底彩色照相檢查,包括視盤下方脈絡膜廣泛缺損(圖3)。OCT檢查,雙眼視盤形態結構異常,未發現類似視盤小凹的凹陷樣改變,周圍可見片狀脈絡膜缺損,缺損區神經上皮結構紊亂、變薄;左眼可見神經上皮劈裂(圖4)。先證者智力發育正常,聽力正常,無唇腭裂,腎功能及血尿(-)。臨床診斷:MAC。先證者父母(Ⅰ1、Ⅰ2)及兄長(Ⅱ1)表型正常。
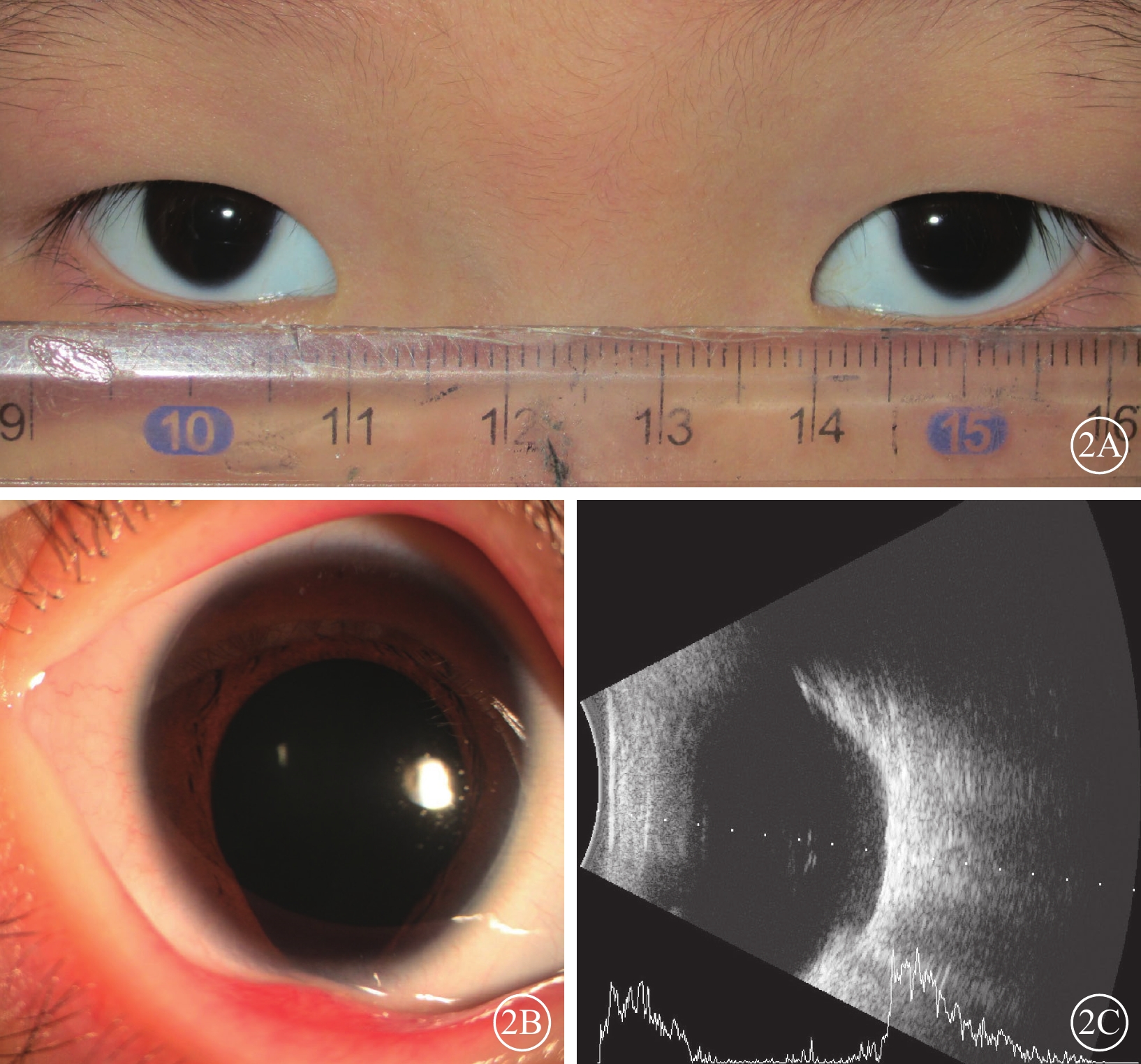 圖2
眼組織缺損家系先證者眼部檢查像 2A示眼外觀像,雙眼角膜豎橢圓形,橫徑均為8.0 mm;陽性Kappa角。2B示右眼眼前節像,瞳孔“鎖孔”虹膜缺損。2C示右眼B型超聲像,眼球壁下方缺損
圖2
眼組織缺損家系先證者眼部檢查像 2A示眼外觀像,雙眼角膜豎橢圓形,橫徑均為8.0 mm;陽性Kappa角。2B示右眼眼前節像,瞳孔“鎖孔”虹膜缺損。2C示右眼B型超聲像,眼球壁下方缺損
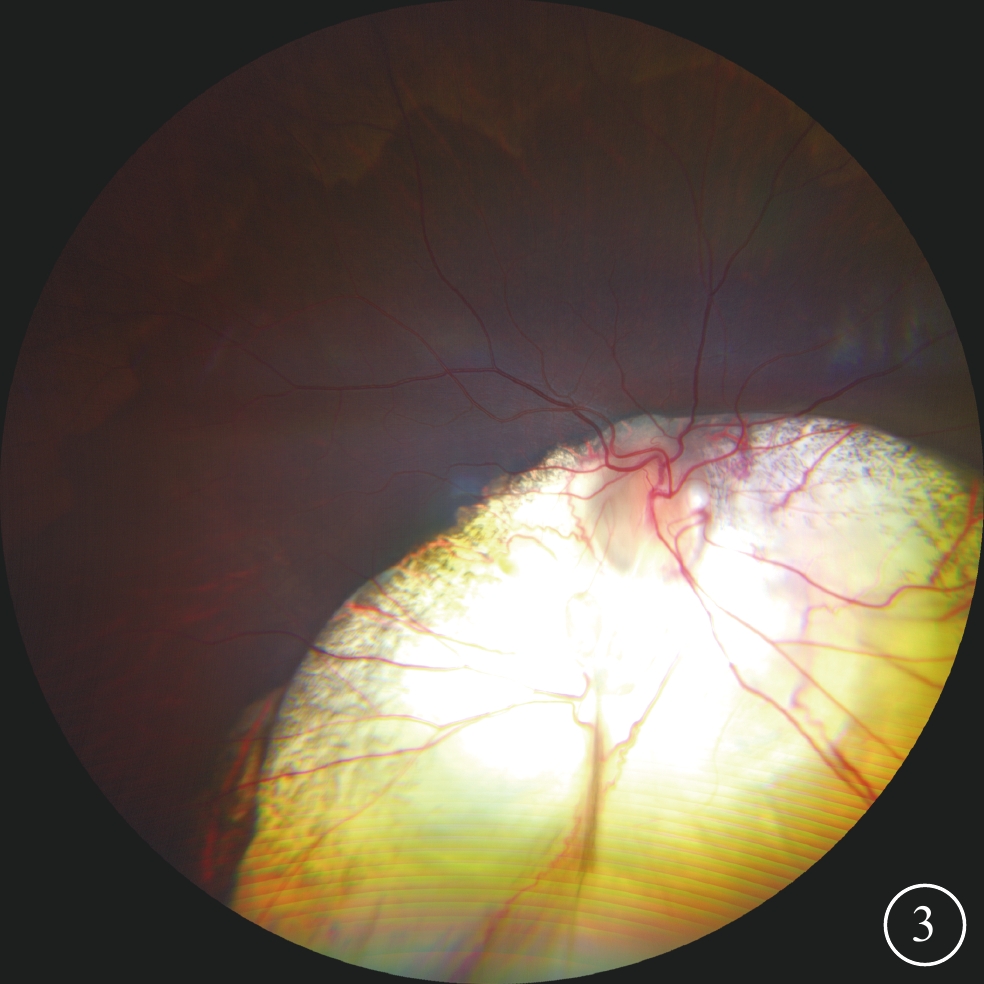
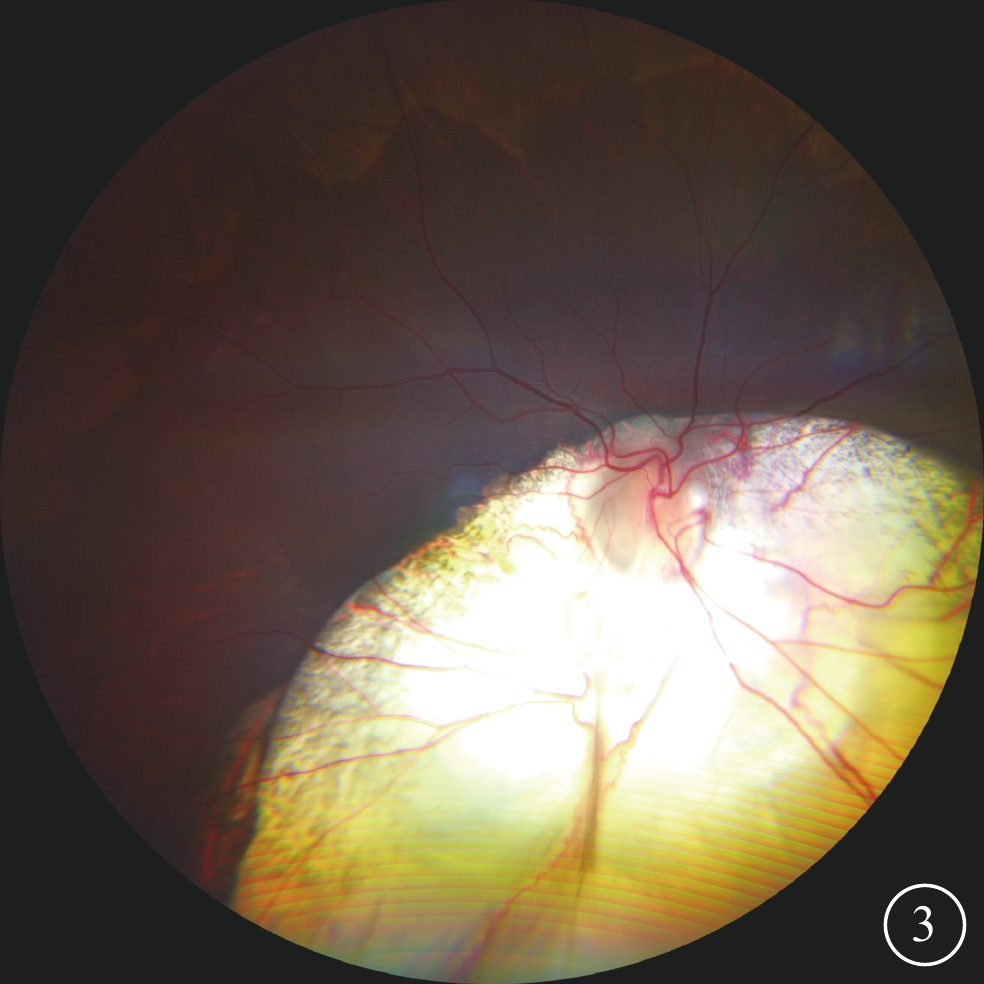 圖3
眼組織缺損家系先證者右眼超廣角彩色眼底像 鼻下象限脈絡膜廣泛缺損,累及視盤
圖3
眼組織缺損家系先證者右眼超廣角彩色眼底像 鼻下象限脈絡膜廣泛缺損,累及視盤
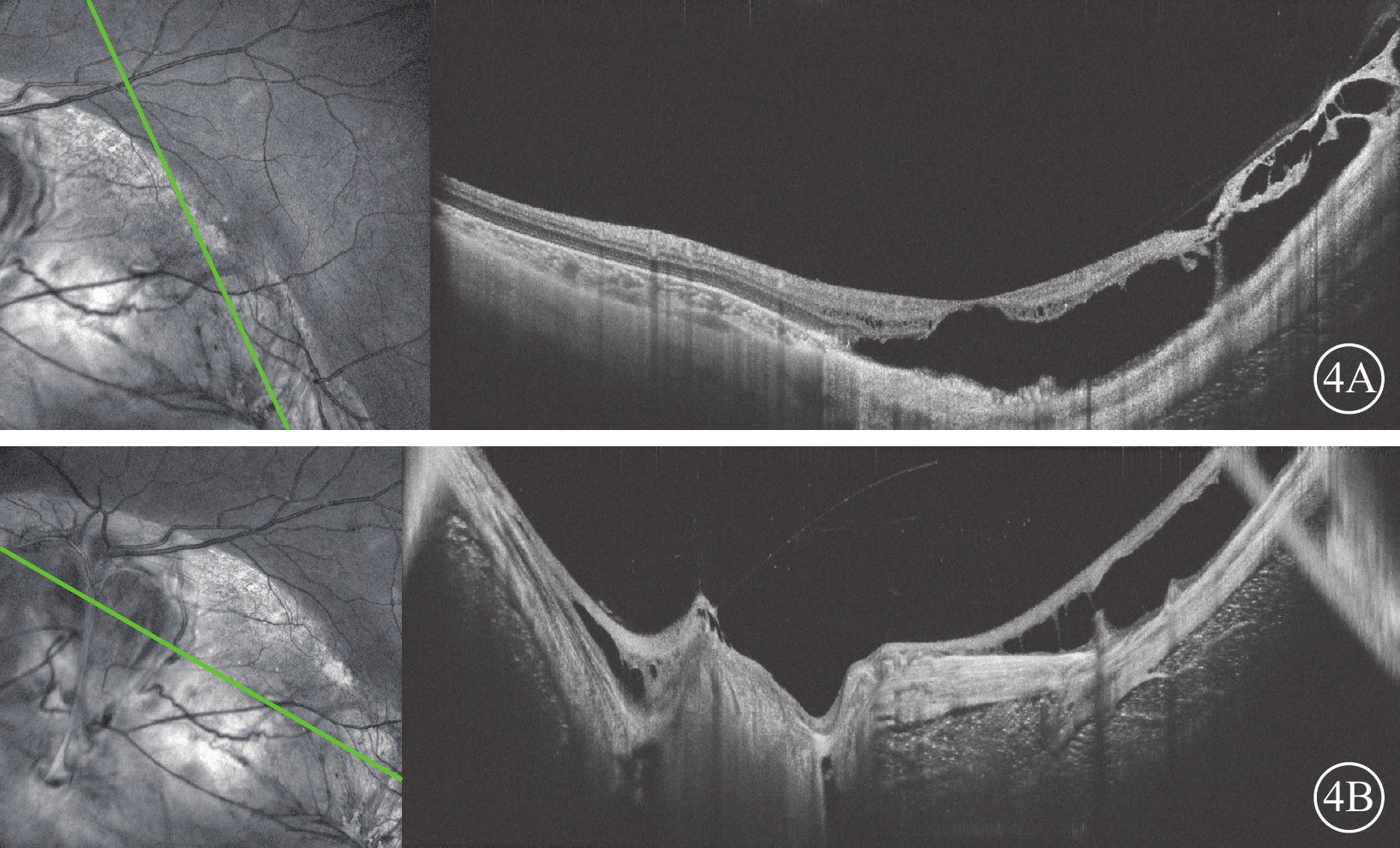
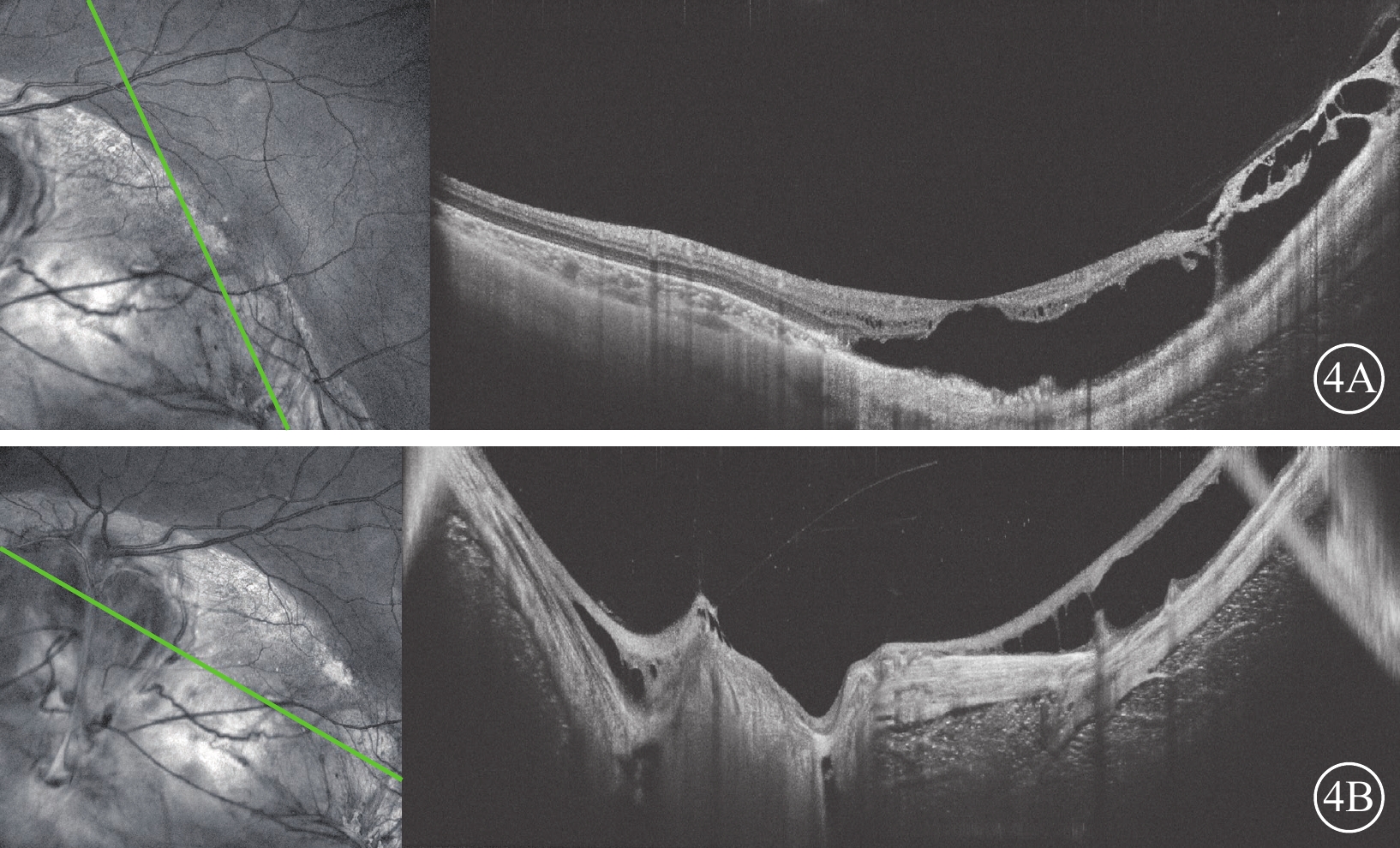 圖4
眼組織缺損家系先證者左眼光相干斷層掃描像 左圖為掃描方向和部位,右圖為檢查結果。4A示黃斑區外層大劈裂腔,黃斑鼻側及下方脈絡膜缺損,缺損區神經上皮結構紊亂;4B示視盤形態結構異常,未見凹陷樣改變,盤周脈絡膜缺損,缺損區神經上皮結構紊亂、變薄,可見神經上皮劈裂
圖4
眼組織缺損家系先證者左眼光相干斷層掃描像 左圖為掃描方向和部位,右圖為檢查結果。4A示黃斑區外層大劈裂腔,黃斑鼻側及下方脈絡膜缺損,缺損區神經上皮結構紊亂;4B示視盤形態結構異常,未見凹陷樣改變,盤周脈絡膜缺損,缺損區神經上皮結構紊亂、變薄,可見神經上皮劈裂
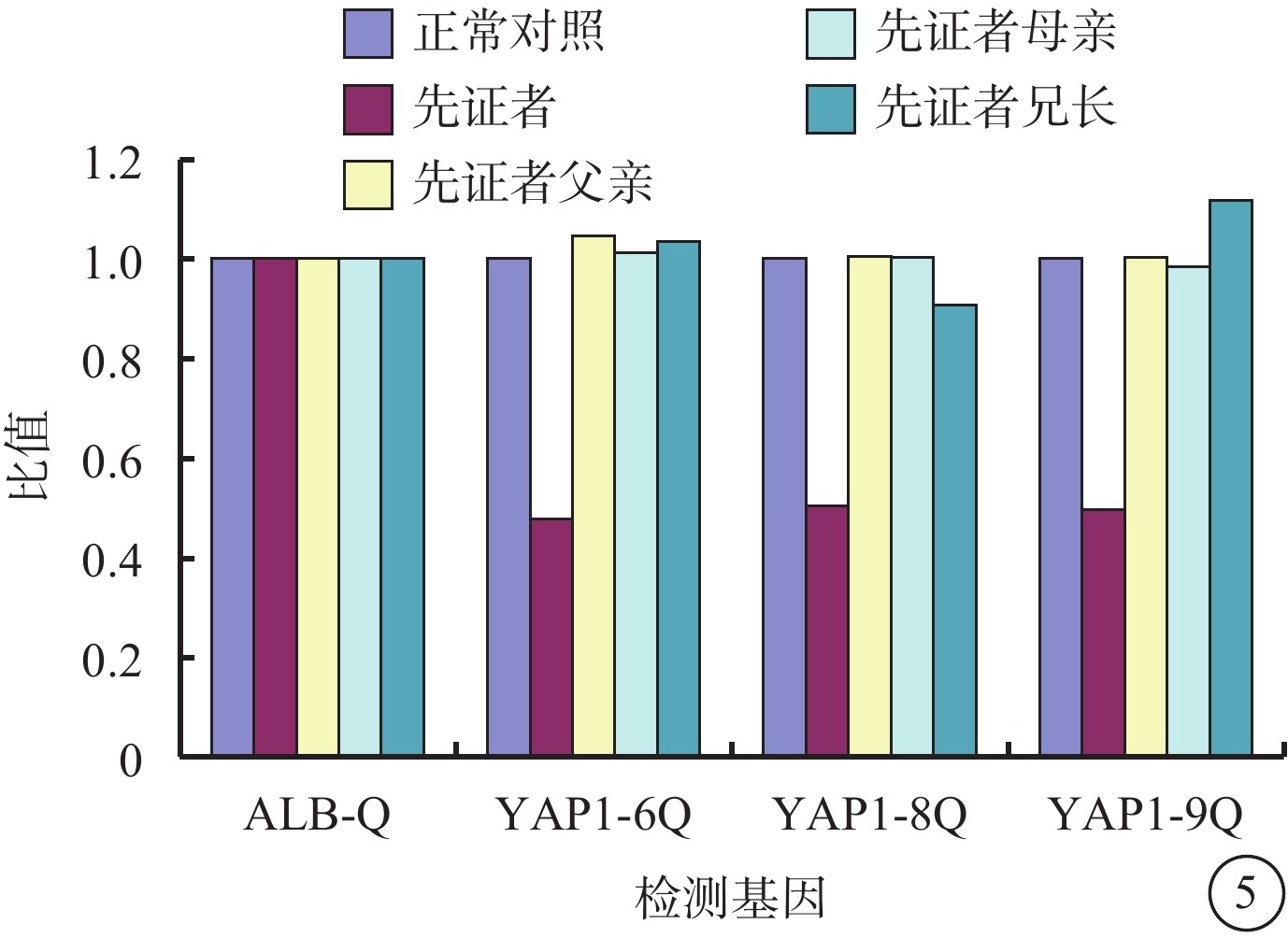
全外顯子組測序結果顯示,先證者YAP1基因6~9號外顯子雜合缺失(約20 kb):YAP1,chr11:102080247-102100671,NM_001130145,loss1(EXON:6-9);父母及兄長均為野生型。熒光定量PCR驗證結果顯示,先證者YAP1基因存在6、8、9號外顯子的拷貝數與正常對照的比值約為0.5,提示存在雜合缺失;先證者父母及兄長YAP1基因的外顯子拷貝數正常(圖5)。該變異為新發(de novo)變異。根據ACMG指南,該變異評級初步判定為致病的(PVS1+PS2+PM2):功能缺失變異導致基因功能可能喪失(PVS1);經雙親驗證為新發變異(PS2);正常對照人群數據庫中均未發現(PM2)。
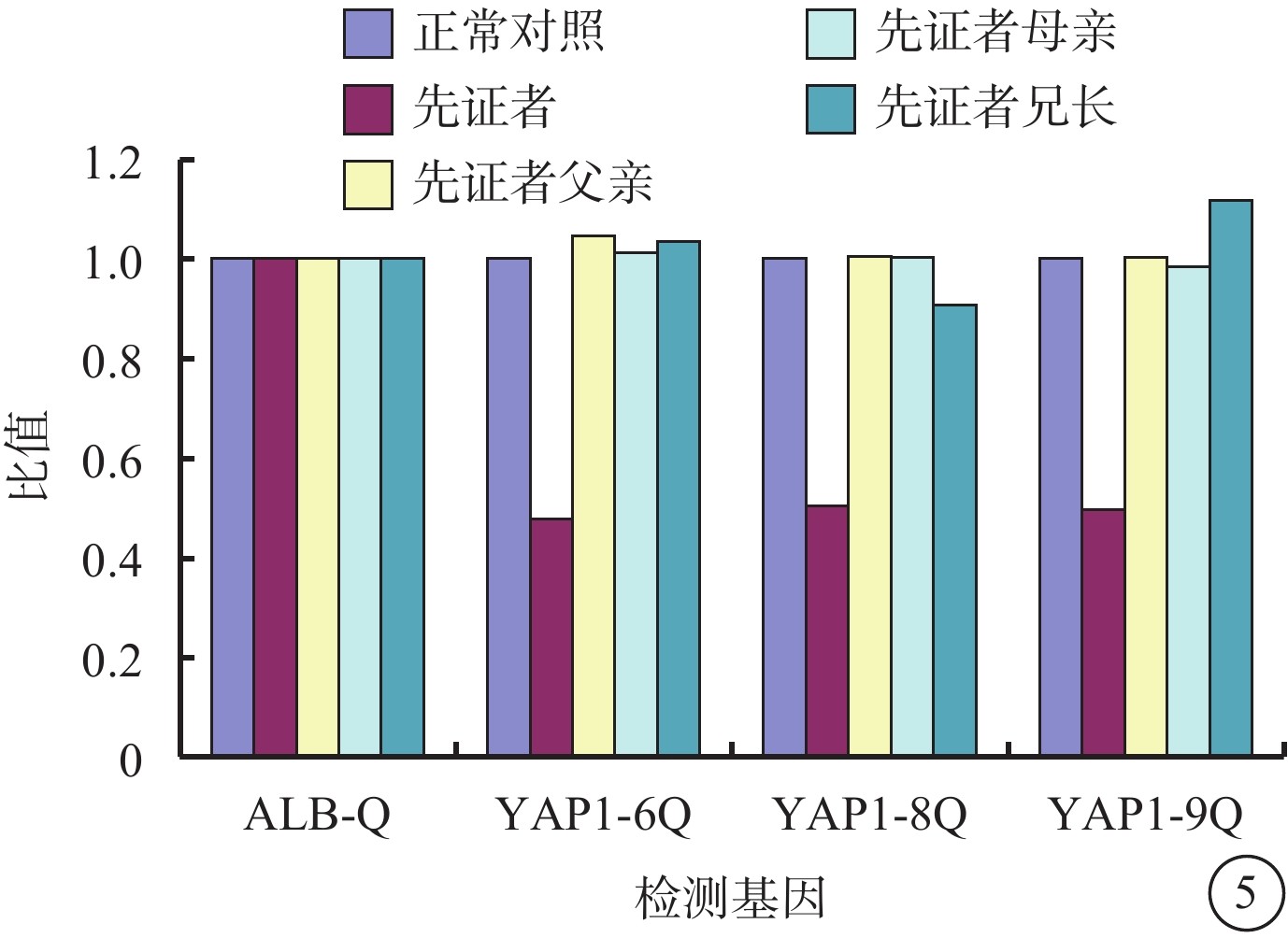 圖5
眼組織缺損家系YAP1基因定量聚合酶鏈反應結果 先證者YAP1基因6、8、9外顯子拷貝數與正常對照比值約為0.5,提示存在雜合缺失;先證者父母及兄長YAP1基因6、8、9外顯子的拷貝數與正常對照的比值約為1.0,提示拷貝數正常
圖5
眼組織缺損家系YAP1基因定量聚合酶鏈反應結果 先證者YAP1基因6、8、9外顯子拷貝數與正常對照比值約為0.5,提示存在雜合缺失;先證者父母及兄長YAP1基因6、8、9外顯子的拷貝數與正常對照的比值約為1.0,提示拷貝數正常
3 討論
我們報道了國人YAP1基因致病變異導致的孤立性MAC一家系。眼球發育相關基因目前已報道20余種,而YAP1基因則較晚定位,患者臨床表型和遺傳特征亦存在一些特殊性。研究發現,Yes關聯蛋白(YAP)與Tafazzin蛋白(TAZ)共結合作為轉錄共激活Hippo途徑的主要效應器,結合TEAD1~4后在器官發生時促進轉錄從而調節器官大小[5-6]。胚眼發育中YAP和TAZ作為視網膜色素上皮(RPE)發生的早期關鍵調節因子,其活性異常導致斑馬魚缺乏RPE細胞亞群和(或)出現MAC,類似于人體YAP1-TEAD1致病變異相關的視盤周圍(盤周)脈絡膜視網膜萎縮和先天性MAC[7]。此外,SOX2與YAP1基因的5′CpG島結合直接調節YAP1表達,兩者呈正相關[8]。YAP1基因致病變異與綜合征型和非綜合征型眼球發育異常均有關聯,有學者認為這與變異是影響單個還是多個轉錄本有關,前者與非綜合征型相關,后者與綜合征型相關[3]。
目前HGMD共收錄了12個YAP1基因變異,與眼部病變相關的9個,然而證實致病的僅為4個。2014年,Williamson等[3]首先在2個胚裂閉合缺陷家系中鑒定出YAP1基因雜合無義致病變異,其中一個家系表現出不一致的眼外受累,包括聽力損失、智力障礙、血尿和唇腭裂;其后,Oatts等[9]在一個MAC和小眼癥家系中發現一個YAP1基因雜合錯義致病變異,并呈現出不完全外顯特征;Holt等[10]在1例患有雙側小眼癥和雙側脈絡膜視網膜病變的男性患兒身上發現了一種新的YAP1基因移碼致病變異,而同基因型的父親并未受累。此外,Fossdal等[11]鑒定出編碼與YAP1的輔因子結合的轉錄增強因子TEAD1基因的致病變異,引起盤周螺旋狀脈絡膜視網膜萎縮,該致病變異發生在TEAD1編碼的結合YAP1的潛在位點上,可能改變了YAP1結合TEAD1的能力,影響其他基因的表達。本家系先證者表現為孤立性MAC,無全身其他系統受累,臨床特征包括豎橢圓形角膜、虹膜缺損、累及視盤的脈絡膜缺損,與Oatts等[9]報道的病例特征十分相似。而YAP1基因E6-9del致病變異預計可影響所有已知的剪接形式,但該患者沒有眼外表型,說明綜合征表型與基因轉錄本無顯著關聯,可能還是與表型易可變性相關。
無眼癥、小眼癥和MAC代表了眼球結構發育缺陷的嚴重程度。MAC患者中SOX2基因或OTX2基因致病變異最為常見,兩者導致了至少60%的雙眼無眼、小眼的嚴重表型,且SOX2基因致病變異中無眼癥可占1/2以上,OTX2基因致病變異中無眼癥可占1/3以上[12]。相比于前兩者,已報道的YAP1基因變異所致表型均較輕微,主要表現為缺損與小眼(小角膜),尚未見無眼表型的報道。我們推測可能YAP1基因作為SOX2基因調節的下游基因,其作用范圍較小,具有更溫和的表型。另外一個眼球發育缺陷相關的常見基因為PAX6, PAX6基因缺陷主要特征是虹膜缺失或發育不良[13-14],而脈絡膜缺損極少被發現[15-16],由此可區別于YAP1基因變異表型。此外,既往文獻報道的不完全外顯性,結合其他基因變異類型甚至少數病例僅累及單眼,更印證了可能與生殖細胞嵌合導致的非同質變異有關[17]。
脈絡膜缺損合并視網膜劈裂的臨床并不常見,Hotta等[18]認為其與視盤小凹中的劈裂發生機制相似。但我們認為兩者存在差異,視盤小凹劈裂與積液來源于蛛網膜下腔和視網膜下間隙的溝通,主要發生于與視盤相連的黃斑區的外核層[19],而本家系先證者視盤OCT掃描顯示其形態的異常區別于視盤小凹;其次,視盤周圍沒有明顯的劈裂,劈裂主要集中于黃斑區,而且內、外叢狀層均能觀察到,類似于高度近視樣劈裂,可能繼發于后鞏膜葡萄腫,隨訪中也發現患兒眼軸增長及近視度數加深過快。文獻報道,脈絡膜缺損繼發視網膜脫離可達40%,原因在于視網膜發育不全及萎縮變薄[20]。因此,對于此類病例,預防眼軸的過快增長和相關的視網膜脫離是隨訪的主要內容之一。
迄今為止,YAP1基因相關眼發育異常僅于英國報道4個家系,本研究報道了國人首例YAP1基因新雜合缺失致病變異的MAC,確認該基因的致病變異可導致中國人MAC表型,引起以眼前節發育異常、脈絡膜缺損、軸性近視加深為特征的孤立性眼部病變,增加了對YAP1基因相關眼發育異常的認識。
眼組織缺損(MAC)屬于先天性發育性眼部異常中的一種,即胚胎發育早期視裂閉合不全引起的眼發育調控紊亂,主要特征包括無眼征、小眼征以及MAC[1]。遺傳類型上可為家族性或散發性,且具有顯著的遺傳異質性,致病基因包括PAX6、SOX2、OTX2、BMP4、BMP7、STRA6等[2]。2014年,Williamson等[3]首次鑒定出常染色體顯性遺傳新致病基因YAP1,除眼組織的缺損征,部分患者表現出不同的眼外特征,包括聽力損失、智力缺損、血尿和唇腭裂。我們在一個孤立性MAC家系中發現YAP1基因的缺失變異。現將結果報道如下。
1 對象和方法
本研究通過河南省立眼科醫院的機構審查委員會審核[批準號:HNEECKY-2017(6)]; 遵循《赫爾辛基宣言》原則;所有受檢者和未成年患者監護人均獲知情并簽署書面知情同意書。
2019年5月至2022年5月于河南省立眼科醫院遺傳眼病門診就診的MAC一家系1例患者(先證者)和3名家系成員(圖1)納入本研究。詳細詢問患者病史和家族史,并行最佳矯正視力(BCVA)、裂隙燈顯微鏡、超廣角眼底彩色照相、光相干斷層掃描(OCT)、B型超聲檢查以及眼軸長度(AL)測量。
 圖1
眼組織缺損家系圖 ↗:先證者;□:正常男性;○:正常女性;WT:野生型
圖1
眼組織缺損家系圖 ↗:先證者;□:正常男性;○:正常女性;WT:野生型
提取基因組DNA。采集先證者及其父母、兄長外周靜脈血并分離白細胞,TIANamp Blood DNA Kit 試劑盒(北京Tiangen Biotech公司)按照操作規程提取全基因組DNA,Qubit? 2.0熒光定量儀(QubitTM雙鏈DNA檢測試劑盒,美國Invitrogen公司)和瓊脂糖凝膠電泳對基因組DNA質量和數量進行評估。
全外顯子組測序。采集先證者及其父母、兄長外周靜脈血3 ml行Trio全外顯子組測序,采用美國IDT公司xGen? Exome Research Panel v1.0試劑盒對DNA目標區域進行捕獲,建立DNA文庫;采用美國Illumina公司Illumina NovaSeq6000高通量測序儀對DNA樣本進行測序,目標序列測序覆蓋度不低于99%。測序過程由北京全譜醫學檢驗實驗室完成。應用Basecall分析軟件BclToFastq得到原始數據,采用fastp軟件對原始數據進行質控,去除接頭、低質量讀數等。采用Burrows-Wheeler Aligner比對軟件與參考序列GRCh37/hg19進行比對統計。使用GATK軟件分析出單核苷酸多態、插入缺失標記等,得到候選基因的全部變異。基于ClinVar(https://www.ncbi.nlm.nih.gov/clinvar/)、人類基因變異數據庫(HGMD,http://www.hgmd.cf.ac.uk/ac/index.php)、人群基因頻率數據庫(gnomAD,https://gnomad.broadinstitute.org/)、外顯子組測序項目(https://esp.gs.washington.edu/drupal/)、千人基因組計劃數據庫(http://www.1000genomes.org/)等公共數據庫和群體頻率數據庫對檢測變異進行生物信息學注釋,并根據數據庫的資料預測其致病或有害影響。采用匯集分子生物學注釋、生物學、遺傳學和臨床特征分析為一體的遺傳病精準診斷云平臺系統分析篩選(北京智因東方轉化醫學研究中心自行開發構建,https://www.chigene.org),結合正常人基因組數據庫、致病變異數據庫、已知四千種遺傳病臨床特征數據庫等及基因數據庫的并行分析算法,依據美國醫學遺傳學與基因組學學會(ACMG)2015年發布的《序列變異解讀標準和指南》對新發變異進行基因變異致病性評估[4]。
采用正常對照、先證者及其父母和兄長樣本,驗證YAP1基因6~9外顯子雜合缺失變異。采用兩步法熒光定量聚合酶鏈反應(PCR),上下游引物各0.25 μl(2.5 μmol/L),樣本DNA 0.5 μl(100 ng),以及SYBR Green Real time PCR Master Mix(SYBR Green熒光定量PCR反應試劑體系)5 μl。反應采用ABI Step One/Plus PCR儀檢測,每個試驗重復2次。以Ct值最低者為基準,計算正常對照和先證者的Ct差值,將先證者Ct值減去此差值。對正常對照樣本和調整后的先證者樣本的Ct值進行比較,若兩者差異超過1,則可能為缺失或重復。再對可能有重復或缺失的外顯子和內參基因同時做熒光定量(3個重復樣),基因組上目標基因拷貝數檢測的內參基因為人血清白蛋白基因ALB。最后用正常對照樣本做可能有重復或缺失的外顯子和內參基因的正常對照濃度梯度的熒光定量標準曲線,得出相應外顯子和內參基因的擴增效率。根據pfaffl計算公式計算得出目標外顯子和內參基因基因組拷貝數的比值。
2 結果
先證者(Ⅱ2)男,首次就診時3歲。監護人述患兒自幼雙眼視力差,眼球震顫。3歲首次就診時屈光度:右眼-4.00 DS/-0.50 DC×105°,左眼-3.50 DS/-1.25 DC×80°;6歲時屈光度及BCVA:右眼-6.50 DS/-2.00 DC×110°→0.05,左眼-6.00 DS/-1.50 DC×80°→0.2。AL:4歲10個月,右眼、左眼分別為24.62、23.92 mm;5歲7個月,右眼、左眼分別為25.24、24.36 mm。雙眼眼球水平鐘擺樣震顫;豎橢圓形小角膜(水平直徑約8.0 mm)(圖2A);虹膜下方缺損,呈“鎖孔”狀(圖2B)。B型超聲檢查,雙眼眼球組織缺損(圖2C)。超廣角眼底彩色照相檢查,包括視盤下方脈絡膜廣泛缺損(圖3)。OCT檢查,雙眼視盤形態結構異常,未發現類似視盤小凹的凹陷樣改變,周圍可見片狀脈絡膜缺損,缺損區神經上皮結構紊亂、變薄;左眼可見神經上皮劈裂(圖4)。先證者智力發育正常,聽力正常,無唇腭裂,腎功能及血尿(-)。臨床診斷:MAC。先證者父母(Ⅰ1、Ⅰ2)及兄長(Ⅱ1)表型正常。
 圖2
眼組織缺損家系先證者眼部檢查像 2A示眼外觀像,雙眼角膜豎橢圓形,橫徑均為8.0 mm;陽性Kappa角。2B示右眼眼前節像,瞳孔“鎖孔”虹膜缺損。2C示右眼B型超聲像,眼球壁下方缺損
圖2
眼組織缺損家系先證者眼部檢查像 2A示眼外觀像,雙眼角膜豎橢圓形,橫徑均為8.0 mm;陽性Kappa角。2B示右眼眼前節像,瞳孔“鎖孔”虹膜缺損。2C示右眼B型超聲像,眼球壁下方缺損
 圖3
眼組織缺損家系先證者右眼超廣角彩色眼底像 鼻下象限脈絡膜廣泛缺損,累及視盤
圖3
眼組織缺損家系先證者右眼超廣角彩色眼底像 鼻下象限脈絡膜廣泛缺損,累及視盤
 圖4
眼組織缺損家系先證者左眼光相干斷層掃描像 左圖為掃描方向和部位,右圖為檢查結果。4A示黃斑區外層大劈裂腔,黃斑鼻側及下方脈絡膜缺損,缺損區神經上皮結構紊亂;4B示視盤形態結構異常,未見凹陷樣改變,盤周脈絡膜缺損,缺損區神經上皮結構紊亂、變薄,可見神經上皮劈裂
圖4
眼組織缺損家系先證者左眼光相干斷層掃描像 左圖為掃描方向和部位,右圖為檢查結果。4A示黃斑區外層大劈裂腔,黃斑鼻側及下方脈絡膜缺損,缺損區神經上皮結構紊亂;4B示視盤形態結構異常,未見凹陷樣改變,盤周脈絡膜缺損,缺損區神經上皮結構紊亂、變薄,可見神經上皮劈裂
全外顯子組測序結果顯示,先證者YAP1基因6~9號外顯子雜合缺失(約20 kb):YAP1,chr11:102080247-102100671,NM_001130145,loss1(EXON:6-9);父母及兄長均為野生型。熒光定量PCR驗證結果顯示,先證者YAP1基因存在6、8、9號外顯子的拷貝數與正常對照的比值約為0.5,提示存在雜合缺失;先證者父母及兄長YAP1基因的外顯子拷貝數正常(圖5)。該變異為新發(de novo)變異。根據ACMG指南,該變異評級初步判定為致病的(PVS1+PS2+PM2):功能缺失變異導致基因功能可能喪失(PVS1);經雙親驗證為新發變異(PS2);正常對照人群數據庫中均未發現(PM2)。
 圖5
眼組織缺損家系YAP1基因定量聚合酶鏈反應結果 先證者YAP1基因6、8、9外顯子拷貝數與正常對照比值約為0.5,提示存在雜合缺失;先證者父母及兄長YAP1基因6、8、9外顯子的拷貝數與正常對照的比值約為1.0,提示拷貝數正常
圖5
眼組織缺損家系YAP1基因定量聚合酶鏈反應結果 先證者YAP1基因6、8、9外顯子拷貝數與正常對照比值約為0.5,提示存在雜合缺失;先證者父母及兄長YAP1基因6、8、9外顯子的拷貝數與正常對照的比值約為1.0,提示拷貝數正常
3 討論
我們報道了國人YAP1基因致病變異導致的孤立性MAC一家系。眼球發育相關基因目前已報道20余種,而YAP1基因則較晚定位,患者臨床表型和遺傳特征亦存在一些特殊性。研究發現,Yes關聯蛋白(YAP)與Tafazzin蛋白(TAZ)共結合作為轉錄共激活Hippo途徑的主要效應器,結合TEAD1~4后在器官發生時促進轉錄從而調節器官大小[5-6]。胚眼發育中YAP和TAZ作為視網膜色素上皮(RPE)發生的早期關鍵調節因子,其活性異常導致斑馬魚缺乏RPE細胞亞群和(或)出現MAC,類似于人體YAP1-TEAD1致病變異相關的視盤周圍(盤周)脈絡膜視網膜萎縮和先天性MAC[7]。此外,SOX2與YAP1基因的5′CpG島結合直接調節YAP1表達,兩者呈正相關[8]。YAP1基因致病變異與綜合征型和非綜合征型眼球發育異常均有關聯,有學者認為這與變異是影響單個還是多個轉錄本有關,前者與非綜合征型相關,后者與綜合征型相關[3]。
目前HGMD共收錄了12個YAP1基因變異,與眼部病變相關的9個,然而證實致病的僅為4個。2014年,Williamson等[3]首先在2個胚裂閉合缺陷家系中鑒定出YAP1基因雜合無義致病變異,其中一個家系表現出不一致的眼外受累,包括聽力損失、智力障礙、血尿和唇腭裂;其后,Oatts等[9]在一個MAC和小眼癥家系中發現一個YAP1基因雜合錯義致病變異,并呈現出不完全外顯特征;Holt等[10]在1例患有雙側小眼癥和雙側脈絡膜視網膜病變的男性患兒身上發現了一種新的YAP1基因移碼致病變異,而同基因型的父親并未受累。此外,Fossdal等[11]鑒定出編碼與YAP1的輔因子結合的轉錄增強因子TEAD1基因的致病變異,引起盤周螺旋狀脈絡膜視網膜萎縮,該致病變異發生在TEAD1編碼的結合YAP1的潛在位點上,可能改變了YAP1結合TEAD1的能力,影響其他基因的表達。本家系先證者表現為孤立性MAC,無全身其他系統受累,臨床特征包括豎橢圓形角膜、虹膜缺損、累及視盤的脈絡膜缺損,與Oatts等[9]報道的病例特征十分相似。而YAP1基因E6-9del致病變異預計可影響所有已知的剪接形式,但該患者沒有眼外表型,說明綜合征表型與基因轉錄本無顯著關聯,可能還是與表型易可變性相關。
無眼癥、小眼癥和MAC代表了眼球結構發育缺陷的嚴重程度。MAC患者中SOX2基因或OTX2基因致病變異最為常見,兩者導致了至少60%的雙眼無眼、小眼的嚴重表型,且SOX2基因致病變異中無眼癥可占1/2以上,OTX2基因致病變異中無眼癥可占1/3以上[12]。相比于前兩者,已報道的YAP1基因變異所致表型均較輕微,主要表現為缺損與小眼(小角膜),尚未見無眼表型的報道。我們推測可能YAP1基因作為SOX2基因調節的下游基因,其作用范圍較小,具有更溫和的表型。另外一個眼球發育缺陷相關的常見基因為PAX6, PAX6基因缺陷主要特征是虹膜缺失或發育不良[13-14],而脈絡膜缺損極少被發現[15-16],由此可區別于YAP1基因變異表型。此外,既往文獻報道的不完全外顯性,結合其他基因變異類型甚至少數病例僅累及單眼,更印證了可能與生殖細胞嵌合導致的非同質變異有關[17]。
脈絡膜缺損合并視網膜劈裂的臨床并不常見,Hotta等[18]認為其與視盤小凹中的劈裂發生機制相似。但我們認為兩者存在差異,視盤小凹劈裂與積液來源于蛛網膜下腔和視網膜下間隙的溝通,主要發生于與視盤相連的黃斑區的外核層[19],而本家系先證者視盤OCT掃描顯示其形態的異常區別于視盤小凹;其次,視盤周圍沒有明顯的劈裂,劈裂主要集中于黃斑區,而且內、外叢狀層均能觀察到,類似于高度近視樣劈裂,可能繼發于后鞏膜葡萄腫,隨訪中也發現患兒眼軸增長及近視度數加深過快。文獻報道,脈絡膜缺損繼發視網膜脫離可達40%,原因在于視網膜發育不全及萎縮變薄[20]。因此,對于此類病例,預防眼軸的過快增長和相關的視網膜脫離是隨訪的主要內容之一。
迄今為止,YAP1基因相關眼發育異常僅于英國報道4個家系,本研究報道了國人首例YAP1基因新雜合缺失致病變異的MAC,確認該基因的致病變異可導致中國人MAC表型,引起以眼前節發育異常、脈絡膜缺損、軸性近視加深為特征的孤立性眼部病變,增加了對YAP1基因相關眼發育異常的認識。